Витамин РР (никотиновая кислота, никотинамид, ниацин) получил также название антипеллагрического витамина (от итал. preventive pellagra – предотвращающий пеллагру), поскольку его отсутствие является причиной заболевания, называемого пеллагрой.
Никотиновая кислота известна давно, однако только в 1937 г. она была выделена К. Эльвегеймом из экстракта печени и было показано, что введение никотиновой кислоты (или ее амида – никотинамида) либо препаратов печени предохраняет от развития или излечивает от пеллагры. В 1904 г. А. Гарден и У. Юнг установили, что для превращения глюкозы в этанол в бесклеточном экстракте дрожжей необходимо присутствие легкодиализируемого кофактора, названного козимазой. Химический состав аналогичного кофактора из эритроцитов млекопитающих был расшифрован в 1934 г. О. Варбугом и У. Кристианом; он оказался производным амида никотиновой кислоты.
Никотиновая кислота представляет собой соединение пиридинового ряда, содержащее карбоксильную группу (никотинамид отличается наличием амидной группы).
Витамин РР малорастворим в воде (примерно 1%), но хорошо растворим в водных растворах щелочей. Никотиновая кислота кристаллизуется в виде белых игл.
Наиболее характерными признаками авитаминоза РР, т.е. пеллагры (от итал. pelle agra – шершавая кожа), являются поражения кожи (дерматиты), пищеварительного тракта (диарея) и нарушения нервной деятельности (деменция).
Дерматиты чаще всего симметричны и поражают те участки кожи, которые подвержены влиянию прямых солнечных лучей: тыльную поверхность кистей рук, шею, лицо; кожа становится красной, затем коричневой и шершавой. Поражения кишечника выражаются в развитии анорексии, тошнотой, болями в области живота, поносами. Диарея приводит к обезвоживанию организма. Слизистая оболочка толстой кишки сначала воспаляется, затем изъязвляется. Специфичными для пеллагры являются стоматиты, гингивиты, поражения языка со вздутием и трещинами. Поражения мозга проявляются головными болями, головокружением, повышенной раздражимостью, депрессией и другими симптомами, включая психозы, психоневрозы, галлюцинации и др. Симптомы пеллагры особенно резко выражены у больных с недостаточным белковым питанием. Установлено, что это объясняется недостатком триптофана, который является предшественником никотинамида, частично синтезируемого в тканях человека и животных, а также недостатком ряда других витаминов (пиридоксина; см. главу 12).
Биологическая роль. Витамин РР входит в состав НАД или НАДФ, являющихся коферментами большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ (формулы ко-ферментов приведены в главе 9).
Показано, что ряд дегидрогеназ использует только НАД и НАДФ (соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа), другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них (например, глутаматдегидрогеназа; см. главу 12). В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами (молекулярные механизмы участия пиридиновых нуклеотидов в этом процессе подробно рассматриваются в главе 9).
Распространение в природе и суточная потребность. Никотиновая кислота также относится к витаминам, широко распространенным в растительных и животных организмах. Для человека основными источниками никотиновой кислоты и ее амида являются рис, хлеб, картофель, мясо, печень, почки, морковь и другие продукты. Суточная потребность для взрослого человека составляет 18 мг.
источник
ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ. Большинство водорастворимых витаминов относятся к группе В и обладают коферментными функциями (входят в состав коферментов и простетических групп)
Большинство водорастворимых витаминов относятся к группе В и обладают коферментными функциями (входят в состав коферментов и простетических групп). Некоферментные свойства витаминов характеризуются способностью участвовать в регуляции метаболизма, проявлять антимутагенное действие, усиливать защитные свойства организма, повышать свертываемость крови и др.
Витамин В1 (тиамин). Молекула тиамина состоит из пиримидинового и тиазолового колец, соединенных метиленовой группой (рис. 33).
Коферментной формой витамина является тиаминдифосфат (тиаминпирофосфат), который участвует в двух важнейших реакциях:
1) в составе декарбоксилаз кетокислот обеспечивает окислительное декарбоксилирование a-кетокислот (пирувата, a-кетоглутарата, кетоаналогов аминокислот);
2) в составе транскетолаз, катализирующих реакции переноса альдегидной группы, осуществляет транскетолазные реакции пентозофосфатных путей и цикла Кальвина.
Рис. 33. Структура витамина В1
Витамин В2 (рибофлавин).Молекула рибофлавина представляет собой гетероциклическое соединение изоаллоксазин (сочетание бензольного, пиразинового и пиримидиновых колец), к которому присоединен 5-атомный спирт – рибитол (рис. 34).
Рис. 34. Структура витамина В1
Коферментными формами витамина являются ФАД и ФМН, структура которых приведена ранее. Флавиновые коферменты служат переносчиками восстановительных эквивалентов и входят в состав дегидрогеназ и оксидаз, катализирующих различные окислительно-восстановительные реакции. ФМН синтезируется из свободного рибофлавина и АТФ, а ФАД – из ФМН и АТФ при участии соответствующих ферментов.
Витамин В3 (пантотеновая кислота). Коферментной формой витамина является кофермент А, или коэнзим А (СоА). Это соединение служит коферментом ацилпереносящих ферментов, принимающих участие в реакциях цикла трикарбоновых кислот, b-окисления жирных кислот и др. Структура витамина представлена на рис. 35.
Рис. 35. Структура витамина В3
Реакционноспособной группой кофермента А служит сульфгидрильная (-SH) группа (рис. 36), расположенная на конце длинной, относительно гибкой цепи. По этой группе с помощью тиоэфирной связи осуществляется присоединение ацильных остатков. Образующиеся в результате производные носят название ацил-СоА. Простейшим ацильным производным является ацетил-СоА, который характеризуется высоким потенциалом переноса ацетильной группы. Он занимает центральное место в реакциях метаболизма углеводов, аминокислот и жирных кислот.
Рис. 36. Структура кофермента А
Витамин В5 (никотинамид, никотиновая кислота, витамин РР). В природе витамин В5 встречается в двух формах: в виде никотиновой кислоты и никотинамида, представляющих собой соединения пиридинового ряда (рис. 37).
Рис. 37. Структура витамина В5
Коферментными формами витамина являются НАД + и НАДФ + , структура которых приведена ранее. Никотинамидные коферменты служат переносчиками восстановительных эквивалентов и входят в состав дегидрогеназ, катализирующих различные окислительно-восстановительные реакции.
Витамин В6 (пиридоксин). Он включает три производных пиридина: пиридоксаль, пиридоксин и пиридоксамин (рис. 38). Каждое из этих соединений способно превращаться в коферментную форму – пиридоксальфосфат. Он входит в состав аминотрансфераз, катализирующих реакции трансаминирования аминокислот. При участии пиридоксальфосфат-зависимых декарбоксилаз происходит декарбоксилирование аминокислот. Коферментные функции пиридоксальфосфата проявляются также в реакциях дезаминирования, изомеризации и синтеза аминокислот, фосфорилирования углеводов, метаболизма жирных кислот и липидов.
Рис. 38. Структура витамина В6
Витамин В9 (фолиевая кислота). Представляет собой птероилмоно-глутаминовую кислоту, которая состоит из производного птеридина, п-аминобензойной и глутаминовой кислот (рис. 39).
Рис. 39. Структура фолиевой кислоты
Коферментной формой фолиевой кислоты является тетрагидрофолиевая, которая осуществляет перенос одноуглеродных фрагментов (рис. 40).
Рис. 40. Структура тетрагидрофолиевой кислоты
Витамин В12 (кобаламин). Это единственный металлсодержащий витамин. Группа кобаламинов представляет собой сложные соединения, состоящие из следующих частей: атома кобальта, двух связанных с кобальтом лигандов (верхнего и нижнего), тетрапиррольного кольца коррина и аминопропанолового мостика (рис. 41).
Атом кобальта связан с четырьмя атомами азота пиррольных колец, которые образуют планарную структуру. Верхний лиганд Х может быть представлен цианид-ионом (цианкобаламин), гидроксильной группой (гидроксикобаламин), ионами нитрита, нитрата, хлора и др. Нижний лиганд представлен нуклеотидом, состоящим из 5,6-диметилбензимидазола, остатков a-D-рибозы и фосфорной кислоты, и расположенным перпендикулярно плоскости коррина. Нуклеотид через аминопропаноловый мостик связан в цикл с заместителем атома углерода одного из пиррольных колец.
Рис. 41. Структура тетрагидрофолиевой кислоты
Коферментной формой витамина является 5’-дезоксиаденозил-кобаламин (кобамамидный кофермент), у которого верхний лиганд представлен остатком 5’-дезоксиаденозина, связанного с атомом кобальта необычной кобальт-углеродной связью.
Биохимические функции аденозилкобаламина состоят в изомеризации соединений, имеющей место в углеводном, азотистом, нуклеиновом и липидном обмене, в биосинтезе метионина из гомоцистеина, восстановлении рибонуклеотидов до дезоксирибонуклеотидов и других процессах.
Витамин С (аскорбиновая кислота). Представляет собой g-лактон 2,3-дегидро-L-гулоновой кислоты. Молекула витамина имеет четыре оптических изомера. Биологически активным соединением является только L-аскорбиновая кислота, которая в организме присутствует также и в виде окисленной формы – L-дегидроаскорбиновой кислоты (2,3-дикето-L-гулоновой кислоты), служащей транспортной формой витамина (рис. 42).
Рис. 42. Структура витамина С
Одним из основных свойств аскорбиновой кислоты является ее способность к обратимым окислительно-восстановительным превращениям, которая лежит в основе физиологической активности витамина: L-аскорбиновая кислота – сильный восстановитель, а образующаяся при этом L-дегидроаскорбиновая кислота легко восстанавливается с помощью редуктазы. Среди множества реакций, протекающих с участием витамина С, можно упомянуть гидроксилирование предшественников некоторых гормонов, синтез коллагена и желчных кислот, расщепление тирозина и лизина и др.
Аскорбиновая кислота служит сильным антиоксидантом, предохраняющим биологически активные вещества клетки от действия свободных радикалов, а также увеличивает всасывание железа и ингибирует образование нитрозаминов (канцерогенов).
Витамин Н (биотин). Молекула биотина состоит из имидазольного и тиофенового колец, являющихся гетероциклической частью, а боковая цепь представлена остатком валериановой кислоты (рис. 43).
Коферментной формой биотина служит N5-карбоксибиотин («активный карбоксил»), который ковалентно связан с белковой частью фермента (рис. 44).
Биотин служит простетической группой ферментов карбоксилаз, катализирующих реакции переноса карбоксильной группы, которые лежат в основе биосинтеза жирных кислот, превращения пирувата в оксалоацетат, синтеза пуриновых оснований, аминокислот и других процессах.
Витамин Р (биофлавоноиды). Это группа соединений фенольной природы, представляющих собой производные флавона (рис. 45). К ним относятся рутин, кверцетин, цитрин, катехины, кумарины, галловая кислота и ее производные.
Биологическое действие биофлавоноидов обусловлено их взаимосвязью с аскорбиновой кислотой. Они препятствуют окислению L-аскорбиновой кислоты в L-дегидроаскорбиновую, а также восстанавливают последнюю при участии глутатиона. Витамин Р регулирует проницаемость и повышает прочность кровеносных капилляров, а также обладает антиоксидантным и противоопухолевым действием.
Дата добавления: 2015-12-22 ; просмотров: 1600 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
источник
В современной медицине, помимо витаминов, применяются также некоторые их производные (коферменты). Установлено, что в роли биокатализаторов чаще всего выступают производные витаминов — коферменты.
Коферменты (коэнзимы) — органические соединения небелковой природы, которые необходимы для функционирования многих ферментов.
Коферменты непосредственно являются катализаторами, функционируя в качестве переносчика электронов, атомов или групп атомов. Чаще всего часть структуры кофермента состоит из того или иного витамина, органического вещества, которое не синтезируется в организме человека и должно доставляться ему в составе пищи. В молекуле кофермента активной частью, соединяющейся с переносимой группой, служит именно витамин.
Тяжёлые заболевания, связанные с недостатком витаминов в пище, являются следствием нарушения обмена веществ в результате снижения концентрации коферментов, участвующих в специфических реакциях с ферментами.
Коферменты играют роль активного центра молекулы фермента.
Есть две группы коферментов:
Для витаминных коферментов исходными веществами являются витамины, поэтому недостаточное поступление их с пищей приводит к снижению синтеза этих коферментов и нарушению в работе соответствующих ферментов.
Невитаминные коферменты образуются в организме из промежуточных продуктов обмена веществ, поэтому недостатка в организме этих коферментов не бывает.
- Витаминные коферменты подразделяются на:
— тиаминовые коферменты (производные витамина В1);
— флавиновые коферменты (производные витамина В2);
— пантотеновые коферменты (производные витамина В3);
— пиридоксиновые коферменты (производные витамина В6);
— фолиевые коферменты (производные витамина В9);
— биотиновые коферменты (производные витамина Н);
— кобамидные коферменты (производные витамина В12);
— липоевие коферменты (производные витамина N);
— хиноновые коферменты. Убихинон или коэнзим Q10;
— карнитиновые коферменты (производные витамина Вт). Карнитин.
- Невитаминные коферменты также делятся на несколько групп:
Изучение действия коферментов показало, что они, обладая низкой токсичностью, имеют широкий спектр действия на организм. Применение коферментов в спортивной фармакологии:
— кокарбоксилаза (коферментная форма тиамина — витамин В1),
— пиридоксальфосфат (витамин В6),
Группа препаратов, созданных на основе производных витаминов, представлена:
— пиридитолом (производное пиридоксина), он имеет мягкий стимулирующий эффект на ткани головного мозга,
— пантогамом (гомолог пантотеновой кислоты, содержащий гаммааминомасляную кислоту),
— оксикобаламином (метаболит витамина В12).
Кокарбоксилаза — кофермент, образующийся в организме человека из поступающего извне тиамина. В спортивной медицине применяется для лечения перенапряжения миокарда и нервной системы, при печёночном синдроме, невритах и радикулитах. Эффект даёт только внутривенное введение в дозе не менее 100 мг.
Кобамамид — обладает всеми свойствами витамина В12 и анаболической активностью. В спортивной медицине применяется для тех же целей, что и витамин В12, а также при перенапряжении миокарда, печёночном синдроме. Способствует увеличению массы скелетных мышц при интенсивных физических нагрузках, улучшению скоростно-силовых показателей и ускорению восстановительных процессов после интенсивных физических нагрузок. Целесообразно сочетание кобамамида с карнитином, с препаратами аминокислот и продуктами повышенной биологической ценности. Рекомендуется прием 2-3 таблеток ежедневно или внутримышечное введение 1000 мкг препарата в день, не менее 20 дней.
Оксикобаламин — является метаболитом цианкобаламина (витамин В12). По фармакологическому действию близок витамину В12, но по сравнению с ним быстрее превращается в организме в активную коферментную форму и дольше сохраняется в крови, так как более прочно связывается с белками плазмы и медленнее выделяется с мочой. Показания к применению такие же, как для В12.
Пиридоксальфосфат — является коферментной формой витамина В6 (пиридоксина). Препарат обладает свойствами витамина В6. Отличается тем, что оказывает быстрый терапевтический эффект, может приниматься в случаях, когда нарушено фосфорилирование пиридоксина. Рекомендуется по 0,02 г 3 раза в день через 15 мин. после еды курсом 10-30 дней. Также источником коферментной формы витамина В6 является спортивное питание «Леветон Форте».
Пиридитол, энцефабол (пиритинол) — фармакологический препарат, проявляет элементы психотропной активности, свойственной антидепрессантам, с седативным действием. Активирует метаболические процессы в ЦНС, способствует ускорению проникновения глюкозы через гематоэнцефалический барьер, снижает избыточное образование молочной кислоты, повышает устойчивость тканей к гипоксии. Малотоксичен, не обладает В6-витаминной активностью. Применяют по 0,1 г 3 раза в день через 15-30 мин. после еды не менее 4 недель. Не рекомендуется принимать в вечерние часы.
Пантогам (гомолог пантотеновой кислоты, содержащий гаммааминомасляную кислоту) — улучшает обменные процессы, повышает устойчивость к гипоксии, уменьшает реакции на болевые раздражения. Активизирует умственную деятельность и физическую работоспособность. В составе комплексной терапии применяют при черепно-мозговой травме. Рекомендуется по 0,5 г 2-3 раза в день через 15-30 мин. после еды. Приём не менее 4 недель.
Карнитин — витаминоподобное вещество, частично поступающее с пищей, частично синтезируемое в организме человека. Способствует окислению жирных кислот, синтезу аминокислот и нуклеиновых кислот. В спортивной медицине рекомендован для повышения работоспособности в видах спорта с преимущественным проявлением выносливости для ускорения течения процессов восстановления. В скоростно-силовых видах спорта оказывает стимулирующее действие на рост мышц. Выпускается как L-карнитин («Элькар», «Карнифит»).
Флавинат — кофермент, который образуется в организме из рибофлавина путём фосфорилирования при участии АМФ. Лекарственная форма получена синтетическим путём. Флавинат применяют при отсутствии эффекта от применения витамина В2. Применяют также при хронических заболеваниях печени, желудочно-кишечного тракта, кожных заболеваниях. Препарат вводят в мышцу медленно.
Липоевая кислота — положительно влияет на углеводный обмен. Ускоряет окисление углеводов и жирных кислот, способствует повышению энергетического потенциала.
Что касается коэнзима Q10, пожалуй, самого известного из коферментов, окончательный вердикт о его пользе для атлетов ещё не вынесен.
По результатам исследований было выявлено, что у людей, не занимающихся спортом, коэнзим Q10 может улучшать качество аэробных упражнений. В то же время у опытных спортсменов, принимавших по 100 мг коэнзима Q10 на протяжении четырёх недель, никаких изменений в уровне выносливости обнаружено не было.
Важно отметить, что коэнзим Q10 в больших дозах (больше 120 мг) может быть вреден, приводит к повреждению мышечной ткани.
источник
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н + ]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn 2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu 2+ — амилазы, Mg 2+ — АТФ-азы (например, миозиновой АТФ-азы).
-присоединении субстратного комплекса фермента;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 9767 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Ферменты – вещества белковой природы, ускоряющие биохимические реакции в организме.
По строению различают простые и сложные ферменты. Простые ферменты состоят из аминокислот – белковой части. Сложные ферменты состоят из белковой и небелковой частей. Небелковая часть называется кофактором. Кофактор может быть представлен производными витаминов, нуклеотидами, металлами.
В процессе биохимической реакции фермент превращает вещество – субстрат. Субстрат связывается с активным центром фермента при помощи водородных, ионных, гидрофобных связей. Активный центр простого фермента представлен радикалами аминокислот. Активный центр сложного фермента представлен кофактором.
Ферменты с четвертичной структурой имеют аллостерический центр, к которому присоединяются низкомолекулярные вещества, регулирующие активность ферментов.
Витамины – сложные вещества, которые участвуют в биохимических реакциях.
Витамины поступают в организм с пищей, ряд витаминов образуется микрофлорой кишечника в организме. При отсутствии какого-либо витамина в организме развивается авитаминоз по этому витамину. При недостатке какого-либо витамина развивается гиповитаминоз. При избытке какого-либо витамина развивается гипервитаминоз.
Витамины делятся на водорастворимые и жирорастворимые.
Витамин В1 – химическое название: тиамин; биологическое название: антиневритный. Образует кофактор тиаминпирофосфат, который входит в состав ферментов, участвующих в реакциях окисления углеводов с целью получения энергии.
При гиповитаминозе наблюдаются слабость, поражение нервной системы: невриты, которые сопровождаются болями, нарушением чувствительности, раздражительность, в тяжелых случаях наблюдаются парезы, параличи, нарушения психики. Эти симптомы связаны с накоплением в нервной ткани пирувата. В окислении пирувата участвует тиаминпирофосфат. Поэтому при гиповитаминозе по тиамину снижается окисление пирувата, и он накапливается в тканях. При этом наиболее чувствительной к накоплению пирувата является нервная ткань, поэтому при гиповитаминозе по тиамину прежде всего развиваются симптомы со стороны нервной системы. Кроме того, нарушение окисления пирувата ведет к недостатку энергии. Снижение энергии в организме также прежде всего сказывается на состоянии нервной системы.
Источниками тиамина являются прежде всего – неочищенные зерна злаков, молодые проростки злаков, мясо, хлеб.
Химическое название – рибофлавин; биологическое название — витамин роста.
Образует кофакторы – флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД). ФМН и ФАД входят в состав ферментов, которые участвуют в реакциях окисления углеводов, жирных кислот для получения энергии.
При гиповитаминозе наблюдается недостаток энергии в организме, что сопровождается снижением роста, слабостью, поражением нервной системы, сердечно-сосудистой системы, нарушением питания, ломкостью волос, ногтей.
Источники – мясо, молоко, яйца, печень, бобовые
Химическое название – пантотеновая кислота.
Образует кофермент – коэнзим А, который входит в состав ферментов, участвующих в окислении углеводов, липидов с целью получения энергии. Также кофермент участвует в синтезе липидов. Поэтому при недостатке пантотеновой кислоты развиваются симптомы – слабость, нарушении функции нервной, эндокринной систем, желудочно-кишечного тракта, поражение кожи.
Источники – мясо, яйца, молоко, печень, микрофлора кишечника.
Химическое название – никотиновая кислота, никотинамид, ниацин; биологическое название – антипеллагрический.
Образует коферменты – никотинамиддинуклеотид (НАД), никотинамиддинуклеотидфосфат (НАДФ). Эти коферменты входят в состав ферментов, которые участвуют в реакциях окисления углеводов, липидов с целью получения энергии. Поэтому при гиповитаминозе по никотинамиду развивается недостаток энергии, поражение органов и систем, поражение кожи – пеллагра (шелушение, зуд, покраснение).
Источники – мясо, молоко, яйца, печень. В организме никотинамид образуется из незаменимой аминокислоты трипотофана, которая поступает с продуктами животного происхождения.
Химическое название – пиридоксин, пиридоксаль, пиридоксамин; биологическое название – антидерматитный витамин.
Образует коферменты – пиридоксальфосфат и пиридоксаминфосфат. Эти коферменты входят в состав ферментов, которые участвуют в реакциях обмена аминокислот, синтезе гема, биогенных аминов, которые регулируют процессы обмена в нервной ткани. При гиповитаминозе по витамину наблюдаются анемия из-за снижения синтеза гема, снижается количество биогенных аминов, что вызывает нарушения со стороны нервной системы, нарушается синтез аминокислот, белков, углеводов. Кроме того, гиповитаминоз проявляется поражениями кожи в виде дерматитов.
Источники – мясо, молоко, яйца, печень, микрофлора кишечника.
Химическое название – фолиевая кислота.
Образует кофермент тетрагидрофолиевая кислота, который входит в состав ферментов, участвующих в синтезе азотистых оснований, аминокислот, а значит в синтезе нуклеиновых кислот, белков, что важно для размножения, развития, созревания клеток.
При гиповитаминозе наблюдается макроцитарная анемия, т.к. нарушается созревание эритроцитов, в результате в крови обнаруживаются незрелые эритроциты – макроциты, у которых снижена функция переноса кислорода.
Источники – растительная пища, микрофлора кишечника.
Химическое название – цианокобаламин, биологическое название – антианемический.
Образует коферменты – метилкобаламин, кобаламин. Эти коферменты входят в состав ферментов, которые участвуют в обмене азотистых оснований, регенерации метионина, синтезе сложных липидов, холина, креатина. При гиповитаминозе развивается макроцитарная анемия из-за нарушения созревания эритроцитов; нарушается синтез липопротеинов и функций мембран из-за недостатка холина, наблюдается снижение образования энергии с участием креатинфосфата.
Источники – мясо, молоко, яйца, печень, микрофлора кишечника
Химическое название – аскорбиновая кислота, биологическое название – антицинготный
Участвует в реакциях синтеза коллагена, обмена аминокислот, окислительно-восстановительных реакциях с целью получения энергии, обеспечивает всасывание железа в тонком кишечнике. При гиповитаминозе нарушается синтез коллагена, что сказывается на состоянии соединительной ткани, она становится слабой, хрупкой, ломкой. Например, становятся ломкими сосуды, в результате могут быть подкожные гематомы, частые носовые кровотечения. Кроме того, при гиповитаминозе развивается железодефицитная анемия, т.к. снижается всасывание железа в тонком кишечнике.
Источники – преимущественно цитрусовые, смородина, шиповник
Химическое название – биотин, биологическое название – антисеборейный.
Биотин участвует в реакциях синтеза углеводов, липидов. При гиповитаминозе наблюдается недостаток углеводов, липидов. Также развивается себорея – нарушения деятельности сальных желез.
Источники – мясо, молоко, печень, рыбий жир.
Витамин Аоению различают простые и сложные. ские реакции в организме. ств
Химическое название – ретинол, биологическое название — антиксерофтальмический
Роль витамина: — участвует в восприятии зрительных образов
— является антиоксидантом – защищает мембраны клеток от повреждений активными радикалами.
Образуется из предшественника β-каротина в печени.
При гиповитаминозе наблюдается куриная слепота, нарушается целостность мембран клеток.
Источники – морковь, перец, томаты, рыбий жир
Химическое название – эргокальцеферол, биологическое название – антирахитический. Образуется из холестерола при участии ультрафиолета.
Витамин Д участвует в процессах всасывания кальция в кишечнике и почках, что способствует его усвоению костями. При гиповитаминозе нарушается всасывание кальция в кишечнике, в результате наблюдается недостаток кальция и фосфора в организме, наблюдается ломкость костей, деформации скелета. У детей развивается рахит.
Химическое название – токоферол, биологическое название – антистерильный.
Участвует в процессах репродукции, является антиоксидантом.
При гиповитаминозе наблюдается бесплодие, невынашивание беременности, нарушение целостности мембран
Источники – растительные масла, подкожножировая клетчатка
Химическое название — менахинон, филлохинон, биологическое название – антигеморрагический
Является коферментом ферментов, которые участвуют в активации факторов свертывания крови. Поэтому при гиповитаминозе наблюдается снижение свертывания крови, частые кровотечения
Источники – растительная пища, микрофлора кишечника
Таким образом, поступление витаминов в организм зависит от состояния желудочно-кишечного тракта, т.е. причинами гиповитаминозов прежде всего являются заболевания пищеварительного тракта и нарушение деятельности микрофлоры кишечника.
Механизм действия ферментов
На первом этапе биохимической реакции происходит взаимодействие фермента с субстратом, образуется фермент-субстратный комплекс. На втором этапе происходит превращение субстрата при помощи активного центра фермента. На третьем этапе происходит отделение продуктов реакции.
Факторы, влияющие на активность ферментов
— ферменты проявляют наибольшую активность при температуре тела – 37 градусов; при снижении температуры активность фермента падает, но при нагревании препарата фермента до температуры тела его активность возобновляется. При температуре выше 40 градусов активность ферментов снижается из-за денатурации фермента, т.к. он является белком
— каждый фермент проявляет максимальную активность при определенной рН, например, фермент желудка пепсин активен при рН 1,5-2,0; ферменты тонкого кишечника работают при рН 7,5-8,0; фермент слюны амилаза требует рН 7,4
— при повышении количества фермента активность увеличивается
— при повышении количества субстрата активность фермента сначала увеличивается, затем не изменяется, т.к. весь фермент насыщен субстратом, и для того чтобы увеличить активность фермента нужно увеличить количество фермента.
Изоферменты – множественные формы фермента, которые катализируют одну и ту же реакцию, но различаются по физико-химическим свойствам: сродству к субстрату, подвижности при электрофорезе, регуляторным свойствам.
Например, фермент лактатдегидрогеназа (ЛДГ) – фермент с четвертичной структурой, содержит 2 типа субъединиц – М и Н. Молекула изоферментов ЛДГ образована 4 субъединицами. Поэтому ЛДГ имеет 5 изоферментов:
— ЛДГ2 состоит из НННМ – Н3М
— ЛДГ3 состоит из ННММ – Н2М2
— ЛДГ4 состоит из НМММ – НМ3
ЛДГ катализирует превращение пировиноградной кислоты в молочную кислоту (лактат).
При электрофорезе наибольшей подвижностью обладает изофермент ЛДГ1, наименьшей – ЛДГ5.
В скелетной мышце и миокарде преобладает активность ЛДГ1, а в печени – ЛДГ5. Это обстоятельство используют в клинической практике для диагностики заболеваний миокарда, скелетных мышц, печени. В норме активность изоферментов ЛДГ в сыворотке крови очень низкая. При повреждении соответствующих органов активность этих изоферментов возрастает в сыворотке крови. При увеличении активности ЛДГ1 в сыворотке крови подозревают поражение скелетных мышц или миокарда. Повышение активности ЛДГ5 в сыворотке крови может свидетельствовать о поражении печени.
Регуляция активности ферментов
Регуляция активности фермента осуществляется на уровне транскрипции и на уровне изменения активности синтезированного фермента.
Регуляция активности фермента на уровне транскрипции рассмотрена на примере лактозного оперона (в теме — Белки).
Регуляция активности синтезированного фермента происходит несколькими путями с участием гормонов.
А. Аллостерическая регуляция
В молекуле фермента различают аллостерический центр, который необходим для связывания различных веществ – активаторов и ингибиторов, которые регулируют активность фермента. Активаторы – вещества, ускоряющие активность ферментов. Например, ионы хлора увеличивают активность амилазы, соляная кислота активирует пепсин, желчь активирует липазу.
Ингибиторы – вещества, снижающие активность ферментов. Различают конкурентное и неконкурентное ингибирование. Конкурентный ингибитор имеет структурное сходство с субстратом, поэтому конкурентный ингибитор может взаимодействовать с активным центром фермента. При этом взаимодействие субстрата с активным центром фермента снижается и активность фермента падает. Неконкурентный ингибитор присоединяется к ферменту в аллостерическом центре, в результате меняется пространственная конфигурация активного центра фермента, и субстрат не может присоединяться к активному центру, поэтому активность фермента падает.
Активность фермента регулируется по принципу прямой положительной связи – присутствие субстрата активирует фермент. Отрицательная обратная связь – продукт реакции ингибирует ферменты, которые принимали участие в синтезе этого продукта на начальных стадиях.
Б. Ковалентная модификация
Этот путь регуляции активности ферментов заключается в следующем. В молекуле фермента присутствуют радикалы серина, тирозина, треонина. К спиртовым группам этих аминокислот присоединяется фосфат, источником которого служит АТФ. Присоединение фосфата к молекуле фермента называется фосфорилированием. Для этого процесса необходим фермент протенкиназа. При фосфорилировании фермент либо активируется, либо инактивируется.
Кроме того, может наблюдаться противоположная реакция – отщепление фосфата от молекулы фермента – дефосфорилирование. Для этого необходим фермент фосфопротеифосфатаза. При этом дефосфорилированный фермент может активироваться или инактивироваться.
Например, в синтезе гликогена участвует гликогенсинтетаза, а в распаде гликогена — гликогенфосфорилаза. Дефосфорилирование этих ферментов приводит к активации гликогенсинтетазы и ингибированию гликогенфосфорилазы, при этом преобладает синтез гликогена, а его распад замедляется. Фосфорилирование гликогенсинтетазы и гликогенфосфорилазы при водит к активации гликогенфосфорилазы и ингибированию гликогенсинтетазы, т.е. преобладает распад гликогена, а его синтез замедляется.
В. Регуляция активности фермента путем ассоциации-диссоциации субъединиц в олигомерном ферменте
Например, неактивная форма протеинкиназы представлена комплексом связанных субъединиц RRCC. При распаде этого комплекса на RR и С, С образуются активные формы фермента – С.
Применение ферментов в медицине
Энзимотерапия – применение ферментов в качестве лекарств. Например, при заболеваниях желудочно-кишечного тракта наблюдается ферментативная недостаточность желудка, поджелудочной железы. При этом нарушается переваривание белков, жиров, углеводов. Для улучшения процессов переваривания используются препараты, которые содержат ферменты, расщепляющие белки, жиры, углеводы в пищеварительном тракте. В хирургии для лечения гнойных ран используются протеолитические ферменты, которые расщепляют белки гнойного содержимого раны, поврежденных тканей, при этом рана лучше очищается от налета.
Высокая активность ферментов может приводить к развитию различных заболеваний. Поэтому в медицине применяются ингибиторы активности этих ферментов, что облегчает состояние больных.
В медицине ферменты стрептокиназа и урокиназа применяются для расщепления тромбов, в результате улучшается кровоток в поврежденных тканях.
Энзимодиагностика – определение активности органоспецифических ферментов в биологических жидкости и использование полученных результатов для диагностики заболеваний. В норме в крови активность ферментов низкая, т.к. ферменты преимущественно находятся в тканях органов – органоспецифичность. Если органы поражаются патологическим процессом, то ферменты из органов высвобождаются в кровь, и обнаруживается высокая активность ферментов в крови.
Ферменты, имеющие диагностическое значение
— аспартатаминотрансфераза – АСТ. Отмечена высокая активность АСТ в мышечной ткани, менее активен фермент в печени. Если в крови обнаруживается высокая активность АСТ, то можно предполагать поражение мышечной ткани или печени
— аланинаминотрансфераза – АЛТ. Отмечена высокая активность фермента в печени, менее активен фермент в мышечной ткани. При повышении активности АЛТ в крови можно предположить поражение печени или мышечной ткани.
— креатинфосфокиназа – КФК. Отмечена высокая активность КФК в мышечной ткани, мозге. При повышении активность КФК в крови можно предполагать поражение мышечной ткани, мозга
— лактатдегидрогеназа – ЛДГ. Отмечена высокая активность ЛДГ в мышечной ткани, печени. При повышении активность ЛДГ в крови модно предполагать поражение мышечной ткани или печени
— гаммаглутамилтранспептидаза. Отмечена высокая активность фермента в печени, почках. При повышении активность фермента в крови можно предполагать патологию печени, желчевыводящих ходов или почек
— щелочная фосфатаза. Отмечена высокая активность фермента в печени, костной ткани. При повышении активности щелочной фосфатазы в крови можно предполагать поражение печени и желчевыводящих ходов, костной ткани.
— панкреатическая амилаза. Отмечена высокая активность фермента в поджелудочной железе. При повышении активности амилазы в крови и моче можно предполагать патологию поджелудочной железы.
Описаны наследственные заболевания, которые связаны с дефектом или отсутствием каких-либо ферментов.
Ферменты используются в лабораторной практике для определения различных метаболитов в биологических жидкостях.
Дата добавления: 2014-01-07 ; Просмотров: 4296 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов.
Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике.
Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями.
Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода:
Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и р-меркаптоэтанол, содержащий SH-rpynny. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих пере-нос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жир-ных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот.
Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В, (тиа-мин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов.
Пиридоксалевые и кобаламидные коферменты являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков.
Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент.
Убихиноновые коферменты (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования.
Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТф, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов.
Свойства ферментов
Для ферментов характерны высокая каталитическая активность, специфичность действия и регулируемость их активности.
Благодаря высокой каталитической активности ферментов скорость некоторых химических реакций увеличивается в миллионы раз. Примером может служить обратимая реакция синтеза и распада угольной кислоты, которую катализирует фермент карбоангидраза: СО2 + Н2О = Н2СО3. Одна молекула карбоангидразы эритроцитов способна связывать до 105 молекул СО2 в секунду, при этом скорость реакции в присутствии фермента увеличивается в 107 раз. Реакция синтеза Н2СО3 постоянно протекает в тканях организма при связывании метаболического СО2, а реакция распада Н2СО3 интенсивно протекает в капиллярах легких, где происходит выведение СО2 из организма при выдохе.
Очень высокую активность проявляет каталаза, которая катализирует расщепление токсичного для организма вещества — перекиси водорода: 2Н2О2 -> 2Н2О + О2. При температуре 0° С одна молекула каталазы разлагает 40 000 молекул Н2О2 в секунду.
Специфичность действия ферментов состоит в том, что фермент может катализировать превращение определенного субстрата или действовать на один из типов химических связей в нем. Благодаря этому в клетке множество химических реакций протекает одновременно в строго определенном порядке. Различают ферменты с абсолютной, относительной и групповой специфичностью. Абсолютная специфичность фермента проявляется в том, что он катализирует превращение молекул только одного субстрата. Например, фермент аргиназа способен катализировать распад только аргинина на мочевину и орнитин, а ферменты сахараза, мальтаза, лактаза способны расщеплять только соответствующие дисахариды. Относительной специфичностью действия обладают ферменты, которые катализируют разрыв определенного типа химической связи в молекулах разных веществ. Для них строение молекулы субстрата не имеет решающего значения. Относительная специфичность характерна для пептидаз пищеварительного тракта (пепсина, трипсина, химотрипсина), которые расщепляют пептидную связь в различных белках и пептидах, а также фосфатаз, липаз, которые расщепляют эфирные связи в молекулах различных веществ. Ферменты действуют только на один из нескольких изомеров субстрата. Групповая специфичность характерна для ферментов, которые действуют на субстраты с одинаковым типом связи и подобным строением молекул. Так, например, холинэстеразы расщепляют эфирную вязь во многих субстратах, которые содержат остаток холина.
Регуляция процессов синтеза ферментов осуществляется на уровне генов и на уровне транскрипции (синтеза иРНК). Такие изменения наблюдаются при долговременном воздействии различных факторов среды, физических нагрузок и стероидных гормонов.
Процессы адаптации организма к физическим нагрузкам взаимосвязаны с совершенствованием различных механизмов регуляции активности ферментов. При срочной адаптации к физическим нагрузкам изменяется активность уже существующих ферментов. При долговременной адаптации в организме усиливаются процессы синтеза белка, что приводит к увеличению количества ферментов. Такие изменения повышают адаптационные возможности обмена веществ. Благодаря регулируемости активности ферментов можно осуществлять коррекцию отдельных звеньев обмена веществ в организме, что является актуальной проблемой медицины и спорта.
Большинство химических составных частей живого организма способно к множеству различных превращений. Фермент, ускоряя только одну какую-либо реакцию, препятствует всем побочным реакциям и тем самым определяет направление основного биохимического процесса.
Скорость реакции зависит от строения молекул реагирующих веществ (реагентов), их концентрации, температуры, давления, наличия катализатора и некоторых других факторов.
Реакция становится возможной только при столкновениях молекул. Чем больше молекул в единице объема, тем чаще они сталкиваются, т.е. скорость реакции повышается.
Не каждое столкновение реагирующих молекул приводит к химической реакции. Чтобы реакция началась, молекулы должны обладать определенным запасом энергии, достаточным для преодоления энергетического барьера, который создается межмолекулярными силами отталкивания и внутримолекулярными силами сцепления (прочностью химических связей).
Особенно большое количество энергии нужно для разрыва ковалентных связей,
преобладающих в молекулах органических веществ. Когда энергетический барьер преодолен и реакция началась, в ходе ее может выделиться значительно больше энергии, чем затрачено на начало процесса. Изменения энергии, происходящие в ходе химических реакций, можно изобразить графически. Количество энергии, необходимое молю реагирующего вещества для вступления в реакцию, называется энергией активации и рассчитывается в кДж/моль.
 |
Чем больше в веществе активных (возбужденных) молекул, способных преодолеть энергетический барьер, тем выше скорость его химических превращений. Запас энергии зависит от особенностей химического строения молекул и тех внешних воздействий, которым они подвергаются. В обычных условиях только незначительная часть молекул вещества находится в активном состоянии. Активация их происходит при нагревании вещества, передаче ему лучистой энергии (например, в фотохимических реакциях), столкновениях с другими, уже возбужденными молекулами или атомами.
С повышением температуры на каждые 10° скорость реакции возрастает в среднем в 2—3 раза. Скорость реакции можно увеличить, повышая давление (если реагенты являются газами): активные молекулы сближаются, и частота столкновений между ними увеличивается.
В живых организмах большие колебания температуры и давления невозможны. В них создаются условия, в которых для взаимодействия веществ требуется меньшая энергия активации. Это достигается снижением энергетического барьера реакции за счет уменьшения сил отталкивания между молекулами и ослабления химических связей.

Согласно современным представлениям, механизм взаимодействия ферментов с субстратами связан с образованием нестойких ферментсубстратных комплексов
В процессе образования фермент-субстратного комплекса в субстрате происходит перераспределение энергии, что приводит к разрыву или образованию химических связей. Так, например, энергия активации сахарозы при гидролитическом расщеплении без фермента составляет 134 кДж / моль»1 (25,6 ккал / моль»1), а в присутствии фермента (сахаразы) — только 39,3 кДж/моль»1 (8 ккал/ моль — 1).
Процесс взаимодействия фермента с субстратом протекает в несколько стадий, представленных на рис:
• взаимодействие субстрата с активным центром фермента и образование ферментсубстратного комплекса;
• преобразование первичного ферментсубстратного комплекса в другие ферментсубстратные комплексы, в ходе которых вещества переходят в активное состояние и далее распадаются на фермент и продукты реакции;
• отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду.
Сам фермент в ходе реакции не изменяется и может взаимодействовать с новыми молекулами субстрата.
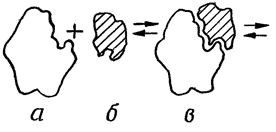 |  |
а- фермент б- субстрат в- фермент-субстрат- е- продукты реакции
Факторы, влияющие на действие ферментов
Скорость биохимических реакций, которая определяется по изменению концентрации реагирующих или образовавшихся веществ в единицу времени, зависит от активности ферментов и условий протекания реакции. Каждый фермент имеет свои оптимальные условия проявления активности. Оптимальными считаются условия, при которых ферментативная реакция протекает с максимальной скоростью. На скорость ферментативных реакций влияют: количество фермента; концентрация субстрата; активная реакция среды (рН); температура; присутствие активаторов и ингибиторов.
Концентрация фермента и субстрата. Скорость ферментативной реакции увеличивается с увеличением количества фермента при высокой концентрации субстрата. В организме в состоянии относительного покоя многие ферменты не проявляют максимальную активность из-за низкой концентрации их субстратов. При мышечной деятельности усиливается энергетический обмен и накапливаются субстраты многих реакций, что способствует повышению активности многих ферментов.
Активная реакция среды. Каждый фермент имеет узкий диапазон значений рН, при котором активность его максимальна. Большинство ферментов проявляют максимальную активность в организме при значениях рН, близких к 7,0, т. е. в нейтральной среде (рис. 39). Однако отдельные .ферменты проявляют высокую активность в сильно кислой среде, например пепсин (рН 2,0), сахараза (рН 4,5), или щелочной среде, например трипсин (рН 8,0), липаза (рН 9,0), аргиназа (рН 9,7).
Влияние рН среды на активность ферментов связано с изменением степени ионизации их белковой молекулы под воздействием протонов Н или гидроксилов (ОН»), что в первую очередь влияет на структуру активного центра фермента.
В организме человека в состоянии относительного покоя диапазон колебаний рН незначителен и ферменты «работают» в своих оптимальных режимах. При интенсивных физических нагрузках в мышцах накапливзетмолочная кислота, способная закислять среду и снижать активность многих ферментов.
Температура. При повышении температуры от 0 до 40 °С активность Ферментов, как правило, повышается (рис. 40). Температурный коэффициент Q10 = 2, что указывает на повышение скорости ферментативной реакции в два раза при изменении температуры на 10 °С. Дальнейшее повышение температуры до 45—55 °С приводит к резкому снижению активности ферментов вследствие тепловой денатурации белка. Все ферменты имеют свою оптимальную температуру, при которой активность их максимальная (для многих ферментов оптимальной является температура 37— 40 °С). Однако имеются и термостабильные ферменты, например миокиназа, активность которой сохраняется при нагревании до 100 °С. При понижении температуры активность ферментов снижается. Тем не менее необратимая денатурация их не происходит, так как в условиях оптимальных температур их активность восстанавливается (примером может служить зимняя спячка животных). Это свойство ферментов используется при замораживании продуктов, а также органов и генетического материала, используемых для трансплантации.
Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов. Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение.
В качестве активаторов могут выступать самые разнообразные вещества. Это прежде всего ионы двухвалентных металлов, таких как Mg 2+ , Zn 2+ , Mn 2+ , Co 2+ , Cu 2+ , Fe 2+ , Ca 2+ . Они вызывают обратимое изменение структуры активного центра. Так, карбоангидраза активируется ионами Zn 2+ , креатинкиназа — ионами Мg 2+ ; АТФ-аза миозина мышц активируется ионами Са 2+ , для каталитической активности ферментов дыхательной цепи необходимы ионы Си 2+ и Fe 2+ .
Активация некоторых ферментов может осуществляться путем модификации их молекулы и не затрагивать активный центр фермента. Так, HCI активирует пепсиноген желудочного сока, переводя его из неактивной формы в активную (пепсин). Панкреатическая липаза активируется желчными кислотами.
В качестве ингибиторов часто выступают вещества, близкие по строению к субстратам, которые связываются с активным центром фермента. Ингибирование бывает обратимое и необратимое. При обратимом ингибировании ингибитор легко отделяется от фермента и активность фермента восстанавливается. При необратимом ингибировании ингибитор прочно связывается с ферментом и закрывает доступ субстрата к активному центру.
Процесс ингибирования широко используется для коррекции обменных процессов в медицине и других областях деятельности человека. Лечебный эффект ряда лекарственных препаратов обусловлен их ингибиторным действием на отдельные ферменты. Среди ингибиторов, которые обратимо ингибируют ферменты, выделяют конкурентные и неконкурентные ингибиторы.
Конкурентные ингибиторы имеют структуру, подобную субстрату, и конкурируют с ним за место связывания в активном центре фермента. В случае конкурентного торможения ингибитор присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. При высокой концентрации субстрата такие ингибиторы неэффективны.
Неконкурентные ингибиторы реагируют не с активным центром фермента, а с другой частью его молекулы. Это вызывает изменение структуры активного центра, что нарушает процесс катализа. Действие таких ингибиторов можно устранить только химическим изменением структуры их молекулы. К неконкурентным ингибиторам относятся ионы тяжелых металлов и их органические соединения (ртуть, свинец, мышьяк и многие яды), способные блокировать SH-группы в ферменте и нарушать или полностью подавлять обменные процессы в организме.
источник
