Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 20.2
«Виды оксидоредуктаз».
см. п.3.
См. таблицу в файле «20.2 Таблица оксидоредуктазы».
Определение.
Оксидоредуктазы – это класс ферментов, которые катализируют окислительно-восстановительные реакции.
Основные группы (не только подклассы) оксидоредуктаз:
дегидрогеназы, оксидазы, оксигеназы,
редуктазы, цитохромы и антиокислительные ферменты.
Что такое окисление и восстановление.
Окисление – это отщепление электрона,
а восстановление – это присоединение электрона.
Окисление и восстановления всегда сопряжены, то есть связаны,
потому что если одно вещество теряет электрон
и при этом окисляется,
то другое вещество этот электрон приобретает
и при этом восстанавливается.
При восстановлении органических субстратов
электроны часто присоединяются в составе атомов водорода
(каждый из которых состоит из одного электрона и одного протона),
источником которых является НАДФН,
который получает атомы водорода в ПФП (п.35).
При окислении органических субстратов
электроны отщепляются обычно в составе атомов водорода,
которые переносятся на кофермент (НАД и др.) или кислород.
Присоединение атомов кислорода
тоже является окислением органического субстрата,
поскольку присоединившиеся атомы кислорода притягивают к себе электронную плотность тех атомов, в которым они присоединились.
1. Д Е Г И Д Р О Г Е Н А З Ы
катализируют реакции дегидрирования,
то есть отщепления атомов водорода (Н).
При этом водород
(2 атома водорода, состоящие из 2 протонов и 2 электронов)
отщепляется от органического субстрата (R)
и переносится на кофермент (на КоФ – НАД+, ФАД или НАДФ+).
Формулируя короче – дегидрогеназы переносят 2 атома водорода
от субстрата на кофермент.
Субстрат до отщепления от него пары атомов водорода
называется восстановленным субстратом
и обозначается так – RН2;
где Н – это атомы водорода, которые будут отщепляться,
а R – это остальные атомы молекулы субстрата.
Субстрат после отщепления от него пары атомов водорода
обозначается так – R
и называется окисленным.
Кофермент, получающий атомы водорода,
до их присоединения обозначается как КоФ,
а после присоединения двух Н обозначается как КоФН2.
Поскольку при отщеплении атомов водорода
вещество теряет вместе с водородом
входящие в состав водорода электроны,
а потеря электронов называется окислением,
то RН2 – более восстановленное вещество, чем R,
а КоФН2 – более восстановленное вещество, чем КоФ.
Поэтому RН2 называют восстановленным субстратом,
а R – окисленным субстратом.
КоФ2 называют восстановленным коферментом
(восстановленной формой кофермента),
а КоФ – окисленным коферментом
(окисленной формой кофермента).
Схема реакции, которая катализируется дегидрогеназами,
может быть представлена в таком виде:
Где RH2 – это восстановленный субстрат
(органический субстрат до отщепления водорода),
КоФ – окисленный кофермент
(кофермент до присоединения к нему отщепленного от субстрата водорода),
R – окисленный субстрат
(органический субстрат после отщепления от него водорода),
КоФН2 – восстановленный кофермент
(кофермент после присоединения к нему отщепленного от субстрата водорода).
Коферменты, которые участвуют в работе дегидрогеназ:
НАД+, ФАД и НАДФ+.
НАД+, ФАД и НАДФ+ – это обозначения окисленных форм коферментов,
а НАДН,Н+, ФАДН2 и НАДФН,Н+ – это обозначения восстановленных форм коферментов.
НАДН, Н+ и ФАДН2 переносят водород
от субстратов в ДЦ (для выработки АТФ),
а НАДФН, Н+ переносит водород от метаболитов ПФП не в ДЦ,
а в реакции,
катализируемые редуктазами и гидроксилазами.
Дегидрогеназы катализируют реакции
процессов окислительного катаболизма.
См. п.32, 45, 65.
2. О К С И Д А З Ы
катализируют дегидрирование,
при котором водород, отщепленный от субстрата, присоединяется к кислороду (О2).
Формулируя короче – дегидрогеназы переносят 2 атома водорода
от субстрата на кислород.
Схема реакции, которая катализируется оксидазами,
может быть представлена в таком виде:
RH2 + О2 ; R + Н2О2.
Где RH2 – это восстановленный субстрат,
R – окисленный субстрат
(органический субстрат после отщепления от него водорода).
Кислород в результате этой реакции восстанавливается.
Для работы оксидоредуктаз нужен кофермент ФАД
и витамин В2 в составе ФАД.
Основные примеры оксидаз –
это ксантин/оксидаза (КсО) в п.71
и моноамин/оксидаза (МАО) в п.105.
КсО участвует в катаболизме пуринов
(аденина и гуанина,
но субстраты КсО – гипоксантин и ксантин;
под действием КсО гипоксантин превращается в ксантин,
а ксантин – в мочевую кислоту).
МАО участвует в окислении аминов (адреналина, например).
Ингибиторы КсО применяются для снижения выработки уратов (см. гипер/урикемии),
а ингибиторы МАО применяются в качестве антидепрессантов.
Оксидазы участвуют в реакциях свободного окисления – п.26.
Сходство и отличия дегидрогеназ и оксидаз:
сходство в том, что катализируют отщепление водорода (дегидрирование),
отличия в том, что
дегидрогеназы переносят отщеплённый от субстратов водород на коферменты,
а оксидазы – на кислород (окси).
катализируют включение в молекулу органического субстрата
атомов кислорода, источником которых является О2.
Атомы кислорода включаются
между атомом водорода органического субстрата
и атомом углерода субстрата,
поэтому молекула органического субстрата
до включения в нее атомов кислорода оксигеназами обозначается так – RН,
а после включения атомов кислорода –
либо R-О-О-Н (если включены оба атома О2),
либо R-О-Н (если включен один атом О2).
3.1). Оксигеназы, которые включают в молекулу субстрата
оба атома кислорода,
называются ДИоксигеназами;
схему реакции можно записать так:
Продукт реакции (R-О-О-Н)
называется органической перекисью.
RООН – более окисленное вещество, чем RН,
то есть окисляется органический субстрат,
а восстанавливается кислород.
3.2). Оксигеназы, которые включают в молекулу органического субстрата
только один атом кислорода,
называются МОНОоксигеназами или гидроксилазами.
Второй атом кислорода молекулы кислорода
соединяется с двумя атомами водорода, образуя молекулу воды;
источником атомов водорода в этом случае является кофермент –
либо НАДФН, либо аскорбат.
Схему реакции можно записать так:
RH + О2 + КоФН2 ; R-О-Н + КоФ + Н2О.
RН – это субстрат, в который должен включиться атом кислорода,
R-О-Н – это субстрат со включенным в него атомом кислорода,
О2 – это источник атомов кислорода,
КоФН2 – это источник атомов водорода.
Субстрат RН – более восстановленный по сравнению с RОН.
В реакции окисляются RН и КоФН2,
а восстанавливается кислород.
-ОН – это спиртовая (гидроксильная) группа,
а RОН – это спирт.
Из-за того, что при действии монооксигеназ
образуется гидроксильная группа,
у них есть синоним – гидроксилазы. (Не путать с гидролазами.)
Нужно уметь написать реакции,
которые катализируют фенилаланин/гидроксилаза
и тирозин/гидроксилаза (п.105 и 68).
И знать значение этих реакций.
Оксигеназы (как и оксигеназы),
участвуют в процессах свободного окисления.
Участвуют в метаболизме ксенобиотиков,
в обмене многих гормонов,
в образовании коллагена.
катализируют присоединение водорода
к органическому субстрату,
при этом источником атомов водорода является НАДФН.
Другой вариант определения –
редуктазы катализируют перенос водорода
от кофермента на органический субстрат.
Действие редуктаз противоположно действию дегидрогеназ.
При получении водорода субстрат восстанавливается,
поэтому редуктазы можно считать восстановителями субстратов.
Схема реакций, которые катализируются редуктазами:
Здесь R – органический субстрат до присоединения водорода,
RН2 – органический субстрат после присоединения к нему атомов водорода,
КоФ2 – восстановленная форма кофермента (источник водорода),
КоФ – окисленная форма кофермента.
В этой реакции органический субстрат восстанавливается (приобретает водород),
а кофермент окисляется (теряет водород).
Редуктазы – основные ферменты восстановительных синтезов –
например, синтеза жирных кислот,
синтеза холестерина (ГМГ-КоА/редуктаза),
синтеза дезокси/рибонуклеотидов (рибонуклеотид/редуктаза).
А глутатион/редуктаза относится к антиокислительным ферментам – п.27.
5. Ц И Т О Х Р О М Ы
участвуют в реакциях изменения валентности металлов –
например, в присоединении электрона к иону железа Fe3+.
В результате ион железа Fe3+превращается в ион железа Fe2+
(восстановление иона железа).
Схема реакции: Fe3+ + е ; Fe2+.
Почему (3+) превращается в (2+) при присоединении электрона – потому что у электрона отрицательный заряд.
Получается (3+) + (1-) = (2+).)
В каких процессах встречаются цитохромы –
цитохромы катализируют ряд реакций дыхательной цепи – п.22;
нужно также помнить цитохром Р 450 – п.118.
6. А Н Т И О К И С Л И Т Е Л Ь Н Ы Е Ф Е Р М Е Н Т Ы .
См. п.27.
Это ферменты, которые участвуют в разрушении активных форм кислорода
и восстановлении окисленных ими веществ клетки
(органических перекисей).
Относятся к антиокислительной системе организма,
к которой также относятся низкомолекулярные антиоксиданты
(витамины А, Е, С и другие).
Благодаря этой системе организм дольше сохраняет молодость
и дольше не появляются такие болезни, как атеросклероз, катаракта и т.д..
Подробнее об антиокислительных ферментах сказано в ответе на вопрос № 27.
Примеры антиокислительных ферментов –
супероксид/дисмутаза,
глутатион/пероксидаза, глутатион/трансфераза,
глутатион/редуктаза, каталаза.
Реакции, катализируемые оксидоредуктазами,
можно разделить на группы –
к одной группе относятся оксидоредуктазы,
которые катализируют восстановление органических субстратов
(редуктазы = восстановители),
а к другой – оксидоредуктазы, которые катализируют
окисление органических субстратов (все, кроме редуктаз).
Оксидоредуктазы, которые катализируют реакции окисления органических субстратов,
можно разделить на три группы:
1) катализирующие отщепление водорода
(дегидрирование) дегидрогеназы и оксидазы,
2) катализирующие присоединение кислорода
(оксигенацию) оксигеназы,
3) катализирующие изменение валентности металлов цитохромы.
Как определить, какая форма субстрата более восстановленная,
а какая – более окисленная:
чем больше водорода в веществе,
тем более восстановлено вещество;
чем больше кислорода в веществе,
тем более окисленное вещество.
источник
| Структурная формула, рациональное название и буквенное обозначение | Перенос | Тип |
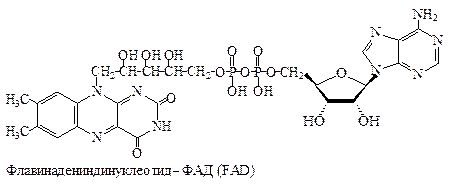 | 2ē и 2Н + | П |
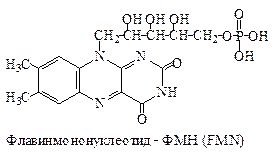 | 2ē и 2Н + | П |
ФМНи ФАД ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона.
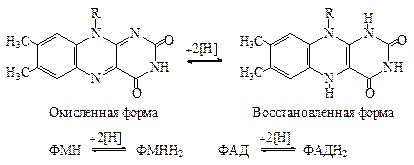
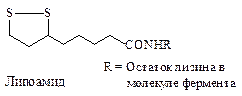 | 2ē и 2Н + | П |
Влипоамиде функцию окислительно-восстановительного центра выполняет внутримолекулярный дисульфидный мостик. Липоевая кислота ковалентно связана с остатком лизина молекулы фермента.
Остаток липоевой кислоты прежде всего участвует в окислительном декарбоксилировании 2-кетокислот.
 | 1ē | П |
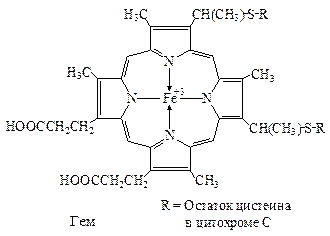
Группагемаявляется окислительно-восстановительным коферментом в дыхательной цепи, фотосинтезе, а также в монооксигеназах и пероксидазах.
В отличие от гемоглобина в этих случаях ион железа меняет валентность.
Гем в цитохроме С, ковалентно связан с двумя остатками цистеина молекулы фермента.
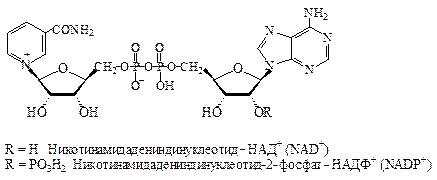 | 2ē и 1Н + | P |
Коферменты НАД + иНАДФ + широко распространены как коферменты дегидрогеназ. Они переносят гидрид-ион(Н ‾ ) и действуют всегдав растворимой форме.
НАД + передает восстановительный эквивалент из катаболического пути в дыхательную цепь и тем самым участвует в энергетическом обмене. НАДФ + , напротив, является самым важным восстановителемпри биосинтезе.
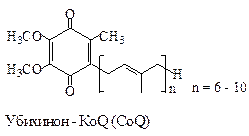 | 2ē и 2Н + | Р |
Убихинонявляется переносчиком восстановительных эквивалентовв дыхательной цепи. При восстановлении хинон превращается в ароматический гидрохинон(убихинол).
Аналогичные системы хинон/гидрохинон принимают участие в реакциях фотосинтеза. К этому классу окислительно-восстановительных систем принадлежат также витамины Е и К.
Из сопоставления таблиц 1 и 2, видно, что такие витамины как рибофлавин, липоевая кислота, липоамид, никотиновая кислота и никотинамид являются предшественниками коферментов оксидоредуктаз.
Гем в чистом виде не применяется в медицинской практике из-за сложности его выделения и синтеза. В качестве препарата, содержащего гем, в медицине применяется препарат крови — «гематоген».
Хотя методы синтеза убихинонов разработаны, до настоящего времени окончательно не установлены пути их биосинтеза. Коферменты Q6–Q9 обнаружены в различных микроорганизмах, а кофермент Q10 в человеческом организме. Интересно отметить, что кофермент Q10 в последнее время нашел применение в косметологии.
Аскорбиновую кислоту также целесообразно отнести к растворимому коферменту, поскольку она принимает участие в реакциях окисления некоторых субстратов кислородом, главным образом в реакциях гидроксилирования. Из биохимических процессов с участием аскорбиновой кислоты следует отметить окисление тирозина, синтезы катехоламинов и желчных кислот. Она является коферментом фермента проколлагенпролин-4-диоксигеназы, катализирующего окисление остатков пролина, входящих в структуру проколлагена, до 4-гидроксипролина в процессе созревания коллагена (Аминокислоты и полипептиды: учеб. пособ. Ч. I./ В.А. Смирнов, Ю.Н. Климочкин. – Самара. Самар. гос. техн. ун-т., 2007, стр.10).
В таблице 3 приведены структурные формулы, названия и буквенные обозначения коферментов, участвующих в реакциях переноса функциональных групп, а также соответствующие ферменты и переносимые ими группы.
Последнее изменение этой страницы: 2017-01-24; Нарушение авторского права страницы
источник
Оксидоредуктазы катализируют окислительно-восстановительные реакции.
При этом происходит перенос атомов водорода или но отдельности протонов и электронов. Схематично действие оксидоредуктаз можно описать уравнением:
Если S, — это нс кислород, то процесс анаэробный, а ферменты называют дегидрогеназами, если S, — кислород, то процесс аэробный, а ферменты в зависимости от условий называют оксидазами или оксигеназами.
Оксидоредуктазы — многочисленный класс ферментов. Их насчитывают более 500. Они являются двухкомпонентными. При такой большой численности оксидоредуктаз набор их кофсрментов довольно ограничен, а субстратная специфичность обусловлена строением белковой части фермента.
Международные названия строятся по принципу:
Наиболее распространены никотинамидные (пиридинзависимые) ко- ферменты. Такое название они получили благодаря амиду никотиновой кислоты (никотинамиду, он же витамин В5), в структуру которого входит гетероцикл пиридин. В составе кофермента есть также азотистое основание аденин и остатки рибозы, соединенные дифосфатной группировкой. Весь кофермент представляет собой объединение двух нуклеотидов. Поэтому полное название кофермента — никотинамидадеииндинуклеотид (НАД) или пикотинамидадениндинуклеотидфосфат (НАДФ).
Разница в строении обусловливает разную локализацию ферментов, содержащих НАД и НАДФ, и взаимодействие с различными субстратами.
Рис. 6.17. Строение коферментов:
В катализируемой реакции проявляет активность непосредственно амид никотиновой кислоты (рис. 6.18).
Рис. 6.18. Работа активного центра НАД и НАДФ
Более половины известных в настоящее время оксидоредуктаз содержат НАД или НАДФ в качестве кофермента.
Флавинзависимые оксидоредуктазы или флавопротеины. Их кофермен- тами являются флавинмононуклеотид (ФМН) (рис. 6.19) или флавинаде- ниндинуклеотид (ФАД) (рис. 6.20).
Активным центром этих коферментов является флавиновый комплекс, который получил свое название за желтый цвет (от греч. flavus — желтый). Как очевидно из рис. 6.21, флавиновые коферменты обратимо переносят атомы Н.
Большинство флавопротеипов — вторичные дегидрогеназы, по некоторые флавопротеины, особенно с ФАД в качестве кофермента, могут пепо-
Рис. 6.19. Структура ФМН
Рис. 6.20. Структура ФАД
Рис. 6.21. Работа активного центра ФАД и ФМН
средственно снимать атомы водорода с субстрата, т.е. являются первичными дегидрогеназами.
Коферментами оксидоредуктаз являются хиноны. В животных организмах — это убихинон (рис. 6.22), а в растительных — пластохинон. Другое их название — кофермент Q. В боковой ветви кофермента Q находятся повторяющиеся 6—10 раз остатки изопрена. Отсюда еще одно название — Ql0. Именно длинная боковая ветвь придает высокую гидрофобность этому ко- ферменту, благодаря чему он легко встраивается в липидный слой мембран.
Рис. 6.22. Участие KoQ. в окислительно-восстановительной реакции
Некоторые оксидоредуктазы в качестве простетической группы содержат липоевую кислоту, которая получила название за липофильные свойства — способность растворяться в органических соединениях и нерастворимость в воде, благодаря чему может легко проникать через различные биомембраны.
Роль липоевой кислоты важна в превращении ПВК в ацетил-КоА (см. рис. 6.13), т.е. в утилизации углеводов. Также липоевая кислота обладает выраженными антиоксидантными свойствами как в жирорастворимых, так и в водорастворимых средах, прерывая свободнорадикальные процессы.
Активную роль при этом играют тиольные (сульфгидрильпые) SH-rpyn- пы (рис. 6.23), поэтому липоевую кислоту относят также к группе тиоль- ных коферментов. Благодаря макроэргической связи, образуемой между атомом S и субстратом, липоевая кислота осуществляет еще и транспорные функции, т.е. входит в класс трансфераз.
К классу оксидоредуктаз относят цитохромы (от греч. cito — клетка, hro- mos — цвет). Из названия ясно, что это окрашенные соединения. По своей при-
Рис. 6.23. Перенос атомов Н липосвой кислотой
роде — это сложные белки хромопротеины. Небелковая часть цитохромов представляет собой гем (рис. 6.24), подобный гему в гемоглобине. Основу гема составляет порфиновое кольцо, которое образуется из четырех пиррольных циклов и метановых групп. В центре порфинового кольца находится атом железа. Поэтому цитохромы и подобные им структуры часто называют железопорфиринами.
Рис. 6.24. Гем и его структурные компоненты
В зависимости от строения гема все цитохромы делят на классы: А, В, С и D. В каждом классе выделяют индивидуальные цитохромы, которые различаются по составу белковой части. Индивидуальные цитохромы обозначают соответствующими латинскими буквами с индексом: av ft, и т.д. Другой способ обозначения индивидуальных цитохромов — указание в индексе характерной длины волны, при которой происходит поглощение в видимой области спектра.
Катион железа в цитохромах участвует в транспорте электронов и обратимо превращается из трехвалентного в двухвалентный (рис. 6.25).
Важной особенностью цитохромов является их способность агрегировать и образовывать цитохромную систему. Принимая электроны от субстрата или от других ферментов, цитохромы передают их по цепочке друг другу, осуществляя окислительно-восстановительные превращения (см. параграф 9.3).
Каталаза и пероксидаза также содержат гемовое железо (гемопротеины, железопорфирины), которое участвует в переносе электронов. Оба фермен-
Рис. 6.25. Схема участия цитохромов в окислительно-восстановительных процессах
та являются компонентами антиоксидантном системы организма и разлагают ядовитый пероксид водорода с образованием нескольких нетоксичных продуктов:
Оба фермента обнаружены в молоке. Содержание каталазы в молоке зависит от ряда зоотехнических факторов: рациона кормления, периода лактации, но, главным образом, от наличия воспалительных процессов в вымени, которые сопровождаются повышенным содержанием соматических клеток в молоке, что установлено по прямо пропорциональной зависимости между этими показателями. Поэтому высокое содержание каталазы в молоке обычно связано с той или иной формой мастита.
Каталаза молока наиболее активна в нейтральной среде (pH 7,0) при 38°С. При пастеризации каталаза разрушается, а если обнаруживается в пастеризованном молоке, то это каталаза бактериального происхождения.
Пероксидазу молока называют лактопероксидаза. Она связана с а-лакт- альбумином сывороточных белков молока и может составлять до 1% общего количества всех сывороточных белков, что намного больше, чем содержание других ферментов. Особенно высоким содержанием лактопероксидазы отличаются молозиво и маститное молоко. Это связано с тем, что данный фермент действует как компонент лактопероксидазной (антибактериальной) системы, уничтожающей патогенные микроорганизмы.
Наибольшую активность лактопероксидаза проявляет при pH 6,8. Она выщенляет из пероксида атомарный кислород и переносит его на легко окисляемые агенты (ароматические амины и кислоты, фенолы, >ТО2-ионы и тиоцианат). Многие из катализируемых лактоиероксидазой реакций сопровождаются изменением цвета, что используют в производственной практике как индикатор на наличие лактопероксидазы. Нагревание до 85°С в течение 10 с гарантированно ее инактивирует, поэтому тест на лактопе- роксидазу используют для контроля режимов температурной обработки молока и сливок.
К классу оксидоредуктаз относится ксаптипоксидаза, обнаруживаемая в молоке. Ее часто называют ферментом Шардингера, по фамилии первооткрывателя. Субстратами ксантиноксидазы являются ксантин, гипоксантин и альдегиды, а также нитраты (NO:3), которые восстанавливаются до нитритов (N02). Продуктами окисления ксантиноксидазы являются кислоты и супероксидные радикалы, поэтому ее относят к прооксидантам.
В организме человека и животных ксантиноксидаза завершает обмен пуриновых оснований образованием мочевой кислоты (рис. 6.26).
Этот фермент имеет олигомерную структуру, состоит из двух субъединиц. В активном центре каждой субъединицы находится кофермент ФАД. Кроме этого с молекулой ксантиноксидазы связаны четыре атома железа и один атом молибдена. Считается, что весь Мо молока входит в состав ксантиноксидазы, и дефицит этого минерала в рационе животных приводит к снижению активности ксантиноксидазы.
Рис. 6.26. Участие ксантиноксидазы в окислении ксантина
В молоке преимущественное количество ксантиноксидазы связано с белками оболочек жировых шариков, поэтому в первую очередь она усиливает процессы окислительной порчи молочного жира. Однако, пока ксантинок- сидаза связана с оболочками молочного жира, она малоактивна. Как только ксантиноксидаза становится свободной, ативность ее повышается. Это может произойти во многих технологических процессах, затрагивающих целостность оболочек жировых шариков молока.
Например, гомогенизация — процесс, требующий намеренного разрушения фосфолипидных оболочек шариков жира. Обычное резервирование молока при 4°С в течение 24 ч сопровождается кристаллизацией молочного жира, а следовательно, и частичным повреждением его оболочек. При нагреве до 70°С в течение 5 мин из таких жировых шариков происходит вытапливание некоторого количества свободного жира. Эти и другие операции, связанные с получением, хранением, транспортировкой и переработкой молока могут способствовать освобождению ксантиноксидазы и ее непосредственному контакту с молочным жиром. Поскольку этот фермент проявляет прооксидантиые свойства, он провоцирует увеличение окислительных процессов в продукте. По данным А. Тенела, молоко с признаками окислительной порчи содержит в 10 раз больше ксантиноксидазы, чем нормальное молоко.
Ферментом антиоксидантной защитной системы организма является супероксиддисмутаза (СОД), нейтрализующая ионы супероксида (О^), возникающие в различных окислительно-восстановительных процессах, в частности, при действии ксантиноксидазы. СОД разлагает их с образованием пероксида и молекулярного кислорода:
Хорошо изучена СОД крови крупного рогатого скота. Это димер, содержащий атомы Си и Zn, свободные SH-группы и одну S—S-связь. Предполагают, что СОД молока имеет идентичное строение. Установлено, что содержание СОД в молоке пропорционально содержанию ксантиноксидазы. Это свидетельствует о том, что СОД синтезируется для компенсации негативного действия ксантиноксидазы.
В молоке СОД сохраняет активность после нагревания до 71°С в течение 30 мин [261.
К классу оксидоредуктаз относятся гидроксилазы, которые катализируют присоединение только одного атома кислорода из его молекулы. Второй атом при этом идет на окисление восстановленных форм НАДН и НАДФН. Гидроксилазы очень активны в надпочечниках млекопитающих. С участием этих ферментов идут многие стадии синтеза стероидных гормонов (см. практический пример 1 в гл. 8).
источник
участвующего в изомеризации углеродного скелета биоактивного соединения :
а. РР б. В 12 в. В2 г .В6 д. фолиевая кислота
35..Какой витамин-кофермент находится в составе фермента ,
участвующего в декарбоксилировании альфа-кетокислот :
а. В 12 б. В 2 в. В1 г .В6 д. фолиевая кислота
- Фермент является представителем класса «оксидоредуктазы». Какое числовое значение надо поставить в коде КФ . . . . для обозначения класса фермента.
- Рабочее название фермента фумаратредуктаза. Какую реакцию катализирует этот фермент?
а. окисление сукцината г. окисление фумарата
б. гидратация фумарата д. декарбоксилирование сукцината
в. восстановление сукцината
38. Рабочее название фермента фосфоенолпируваткиназа. Класс фермента :
а. синтетаза г. трансфераза
39. Рабочее название фермента L- малат:гидролиаза. Какую реакцию
Катализирует этот фермент
а. присоединение воды к яблочной кислоте
б. отщепление воды от яблочной кислоты
в изомеризация яблочной кислоты из одной стереоформы в другую
г. перенос (ОН) -группы на другой субстрат
д. окисление яблочной кислоты
40. Какой витамин может быть в составе кофермента оксидоредуктазы:
а. РР б. В1 в. В12 г.В6 д. фолиевая кислота
Приобретенная энзимопатия всегда сопровождается
а. изменением активности фермента
б. присутствием изоферментов
в. присутствием нетипичных изоферментов
г. сохранением активности фермента
Больному проводят лечение тромбоза сосудов с помощью фермента фибрино-
Лизина. Какой способ введения является подходящим, учитывая химические и
Биохимические свойства препарата.
а. перорально, в виде таблеток г. внутривенно, раствор
б. перорально, в растворе д. перорально, таблетки, раствор
43. Какие ограничения использования ферментов в качестве лекарственных препаратов могут возникнуть в процессе энзимотерапии ( 2 ответа):
а. низкая растворимость в воде г. наличие антигенных свойств
б. способность к протеолизу д. специфичность действия
в. неспецифичность действия
44. Какие свойства лекарственного препарата фермента являются основными показаниями для его использования в энзимотерапии :
а. ограниченная растворимость в воде
б. хорошая растворимость в воде
в. отсутствие специфичности
д. наличие антигенных свойств
45. Какой фермент плазмы крови используют в энзимодиагностике состояния печени?
а. лактатдегидрогеназа (ЛДГ1) г. аспартатаминотрансфераза (АСТ)
б. креатинкиназа ( ВВ) д. креатинкиназа( МВ)
в. аланинаминотрансфераза( АЛТ )
Применение витаминов В1, В2, В6, В12 в качестве лекарственных препаратов связано с тем, что
а. не синтезируются в организме
б. входят в состав субстратного центра фермента
в . входят в состав аллостерического центра фермента
г. входят в состав каталитического центра фермента
д. подвергаются химическим реакциям в организме
47. При инфаркте миокарда в крови обнаруживают изоферменты лактатдегидрогеназы :
Содержание в плазме крови изофермента креатинкиназы состава МВ определяют для диагностики
а. состояния печени г. инфаркта миокарда
б. заболеваний мышечной системы д. заболеваний ж.к.тракта
в. нарушения мозгового кровообращения
49. Для лечения язвенно-некротических осложнений в хирургии применяют препарат фермента:
а. гиалуронидазы г. трипсина
б. стрептолиазы д. рибонуклеазы
50. К современным препаратам системной энзимотерапии следует отнести:
а. мезим в. трипсин д. коллагеназу
б. вобэнзим г. альфа-антитрипсин
Профильный раздел : Биохимия полости рта
51. В составе слюны содержатся ферменты ДНК-азы и РНК-азы. Выберите класс и биологическую роль:
а. гидролазы, пищеварительная
б. гидролазы, антибактериальная
в . изомеразы, антибактериальная
г. изомеразы, пищеварительная
д. трасферазы, антибактериальная
52.Фермент слюны амилаза переваривает крахмал . Выберите класс и тип связей, на которые действует амилаза
а. изомераза, α — гликозидные
б. гидролаза ß — гликозидные
г. изомераза , сложноэфирные
д. гидролаза , α- гликозидные
53. Анаэробные микроорганизмы полости рта выделяют в состав слюны фермент ЛДГ- лактатдегидрогеназу. Определите класс фермента и преобладающую в слюне изоферментную форму.
54. Какой ферментный препарат можно применять для лечения пародонтоза в виде внутримышечных инъекций при сочетании с введением в область пародонта?
а. тромболитин в.стрептолиазу д. трипсин
б. фибролизин г. дезоксирибонуклеазу
55. Фермент гиалуронидазу применяют:
а. для заместительной терапии при заболеваниях поджелудочной железы
б. при местном воздействии для обработки гнойных ран6
в. для заместительной терапии при снижении секреции ферментов в желудке
г. рассасывания рубцов после операций в челюстно-лицевой хирургии
д. в качестве противовирусного препарата
56. В энзимотерапии для лечения язвенно-некротических гингивитах, пародонтите применяют препарат фермента :
а. гиалуронидазы г. фибринолизина
б. стрептолиазы д. рибонуклеазы
57. В челюстно-лицевой хирургии для предотвращения образования рубцов, контрактур применяют энзимотерапевтическое средство:
а . гиалуронидазу г. трипсин.
б. стрептолиазу д. рибонуклеазу
58. Для полной санации канала и предупреждения развития микрофлоры предложили использовать в составе пломбировочного средства фермент
а. коллагеназу г. антитрипсин.
Дата добавления: 2015-11-05 ; просмотров: 623 | Нарушение авторских прав
источник
Общая характеристика класса оксидоредуктаз. Коферменты и простеические группы оксидоредуктаз. Привести конкретные примеры метаболических реакций с участием дегидрогеназ и оксидаз.
Оксидоредуктазы — Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД,НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Если рассматривать все подклассы, то в них выделяются группы ферментов, действующие на:
1.1. CH-OH группу доноров;
1.2. альдегидную или кетоновую группу доноров;
1.3. CH-СH группу доноров;
1.4. CH-NH2 группу доноров;
1.5. CH-NН группу доноров;
1.6. НАДH или НАДФН в качестве доноров;
1.8. содержащие серу группы доноров;
1.9. гем-содержащие доноры;
1.10. дифенолы в качестве доноров;
1.11. пероксид водорода в качестве акцептора;
1.11. водород в качестве донора;
1.13. один донор с включением молекулярного кислорода;
1.14. два донора с включением молекулярного кислорода;
1.15. супероксидные радикалы в качестве акцептора;
1.17. СН2 группу доноров;
1.18. ферредоксин в качестве донора;
1.19. флаводоксин в качестве донора;
1.20. фосфор или мышьяк в качестве донора;
1.21. на вещества Х-Н и Y-Н с образованием X-Y-связи;
1.22. галоген в качестве донора;
1.97. другие оксидоредуктазы.
На подподклассы деление производится в зависимости от акцептора – НАД+ или НАДФ+ (1.1.1., 1.2.1., 1.3.1., 1.4.1.), дисульфиды (1.2.4.), кислород (1.3.3.). Например, каталаза (КФ 1.11.1.6), пероксидаза (КФ 1.11.1.7).
Наиболее распространены следующие рабочие названияоксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Характеристика фермента
| Систематическое название | Сукцинат:ФАД-оксидоредуктаза |
| Рабочее название | Сукцинатдегидрогеназа |
| Класс | 1. Оксидоредуктазы |
| Подкласс | 1.3. Действующие на СН-СН-группу доноров |
| Подподкласс | 1.3.99. с ФАД + в качестве акцептора |
| Кофакторы | Флавинадениндинуклеотид |
Характеристика фермента
| Систематическое название | Фенилаланин.Тетрагидробиоптерин:кислород-оксидоредуктаза |
| Рабочее название | Фенилаланин-4-монооксигеназа Фенилаланин-гидроксилаза |
| Класс | 1. Оксидоредуктазы |
| Кофакторы | Тетрагидробиоптерин. Железо. |
Общая характеристика класса трансфераз. Коферметны трансфераз. Привести конкретные примеры метаболических реакций с участием трансфераз. Диагностическое значение определения аминотрансфераз в сыворотке крови.
Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп.
Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.
Если рассматривать все подклассы, то в них выделяются группы ферментов в зависимости от состава переносимой группы
2.1. переносящие одноуглеродные фрагменты;
2.2. переносящие альдегидные и кетогруппы;
2.3. переносящие ацильные группы;
2.4. переносящие гликозильные группы;
2.5. переносящие неметильные алкильные и арильные группы;
2.6. переносящие азотсодержащие группы;
2.7. переносящие фосфорсодержащие группы.
2.8. переносящие сульфосодержащие группы;
2.9. переносящие селенсодержащие группы.
Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы.
Систематическое название образуется:
Донор группы : акцептор группы – переносимая группа трансфераза.
Характеристика фермента
| Систематическое название | АТФ:D-гексоза-6-фосфотрансфераза |
| Рабочее название | Гексокиназа |
| Класс | 2. Трансферазы |
| Кофакторы | Магний |
Характеристика фермента
| Систематическое название | L-Аспартат:2-оксоглутарат-аминотрансфераза |
| Рабочее название | Аспартатаминотрансфераза |
| Класс | 2. Трансферазы |
| Кофактор | Пиридоксальфосфат |
Аминотрансферазы (трансаминазы) — ферменты, катализирующие межмолекулярный перенос аминогруппы от соответствующих аминокислот на a‑кетокислоты (2‑оксокислоты) с образованием новых кето- и аминокислот без образования свободного аммиака, в качестве кофермента используется витамин В6 (пиридоксин). Эти ферменты играют центральную роль в обмене белков, осуществляя окислительное дезаминирование аминокислот опосредованно через глутаминовую кислоту. Образующаяся глутаминовая кислота дезаминируется глутаматдегидрогеназой с освобождением свободного аммиака и 2‑оксоглутаровой кислоты.
В организме наибольшее значение имеют две аминотрансферазы: аспартатаминотрансфераза (АСТ или АсАТ) и аланинаминотрансфераза (АЛТ или АлАТ). В клинической практике чаще всего определяют именно активность этих двух ферментов. Реакции, катализируемые этими ферментами:
2-Оксоглутарат + Аспартат ↔ Глутамат + Оксалоацетат
2-Оксоглутарат + Аланин ↔ Глутамат + Пируват
Наибольшая активность АСТ обнаружена в миокарде, затем в порядке убывания в печени, скелетных мышцах, головном мозге, почках. Активность фермента в миокарде в 10000 раз выше, чем в сыворотке крови. Активность АЛТ максимальна в печени, среди других органов убывает в последовательности: поджелудочная железа, сердце, скелетные мышцы, селезенка, легкие. Избирательная тканевая локализация позволяет считать трансаминазы маркерными ферментами: АСТ для миокарда, АЛТ для печени. Соотношение активности аминотрансфераз позволяет судить о глубине повреждения клеток: АЛТ преимущественно локализована в цитоплазме, АСТ — в цитоплазме и в митохондриях.
Определение активности АСТ и АЛТ является чувствительным тестом для диагностики инфаркта миокарда, который не выявляется на ЭКГ, активность АСТ возрастает через 4‑6 часов от начала ангинального приступа, спустя 24‑36 часов достигает максимума и нормализуется на 3‑7 день. Вторичное повышение свидетельствует о повторном инфаркте. Особенно важное значение имеет определение активности аминотрансфераз для диагностики заболеваний печени. Некроз или повреждение печеночных клеток любой этиологии (острый и обострения хронического гепатита, холестатическая и обтурационная желтуха, лекарственно-индуцированное поражение) сопровождаются повышением активности обоих ферментов, преимущественно АЛТ, коэффициент де Ритиса = АСТ/АЛТ
Дата добавления: 2018-08-06 ; просмотров: 674 ; ЗАКАЗАТЬ РАБОТУ
источник
КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современная классификация ферментов разработана Международным биохимическим союзом (1961г.). В ее основу положен тип катализируемой реакции и механизм. Все ферменты делят на шесть классов: I. Оксидоредуктазы. II. Трансферазы. III. Гидролазы. IV. Лиазы. V. Изомеразы. VI. Лигазы.
Каждый фермент имеет кодовый номер по классификации ферментов: первая цифра характеризует класс реакции, вторая − подкласс, третья − подподкласс, четвертая цифра указывает порядковый номер фермента в его подподклассе. Название фермента состоит из двух частей: в первой части − название субстрата (или субстратов), во второй − тип катализируемой реакции.
Оксидоредуктазы катализируют окислительно-восстановительные реакции и подразделяются на 5 основных подклассов:
Оксидазы. Катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Оксидазы содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2).
Общая схема процесса следующая:
В качестве субстратов оксидаз могут выступать фенолы, полифенолы, амины. Примерами ферментов класса оксидаз являются фенолаза, цитохром-оксидаза, моноаминоксидаза, уриказа.
Фенолаза (катехолоксидаза, тирозиназа) − медьсодержащий фермент с широкой специфичностью. Он катализирует превращение монофенола
(в присутствии о-дифенола) в орто-хинон. Медь содержится также в уриказе, катализирующей окисление мочевой кислоты в аллантоин, и в моноаминоксидазе, окисляющей адреналин и тирамин в митохондриях.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe 2+ в состояние Fe 3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Аэробные дегидрогеназы. Катализируют удаление водорода из суб-страта, используя в качестве акцептора водорода не только кислород, но и искусственные акцепторы (например, метиленовый синий). Эти дегидрогеназы относятся к флавопротеинам.
В результате реакции образуется пероксид водорода, а не вода:
В качестве кофермента дегидрогеназы содержат ФАД (флавинаденин-динуклеотид) или ФМН (флавинмононуклеотид). Многие флавопротеиновые ферменты содержат несколько ионов металлов.
К ферментам группы аэробных дегидрогеназ относятся: дегидрогеназа L-аминокислот (оксидаза L-аминокислот), катализирующая окислительное дезаминирование природных L-аминокислот, и ксантиндегидрогеназа (ксантиноксидаза), катализирующая окисление ксантина в мочевую кислоту. Молибденсодержащий фермент ксантиноксидаза играет важную роль в катаболизме пуриновых оснований.
Анаэробные дегидрогеназы. Катализируют удаление водорода из субстрата, но не способны использовать кислород в качестве акцептора.
Общая схема процесса следующая:
Анаэробные дегидрогеназы подразделяются в зависимости от природы кофермента на несколько групп.
НАД + -зависимые (пиридинзависимые, первичные) дегидрогеназы, содержащие в качестве кофермента НАД + или НАДФ + . В общем случае НАД + -зависимые дегидрогеназы катализируют окислительно-восстановительные реакции специфических (например, гликолиза) и общих путей катаболизма (например, цикла Кребса, дыхательной цепи).
Общая схема процесса следующая:
Примером НАД + -зависимых дегидрогеназ могут служить лактатдегидрогеназа, алкогольдегидрогеназа, глутаматдегидрогеназа и др. Например, 1.1.1.27 L-лактат: НАД + -оксидоредуктаза (лактатдегидрогеназа) катализирует взаимопревращение лактата и пирувата:
ФАД- и ФМН- зависимые анаэробные дегидрогеназы (флавин-зависимые дегидрогеназы). Первичные флавинзависимые дегидрогеназы переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. К ним относятся, например, 1.3.99.1 сукцинатдегидрогеназа (СДГ), ацил-КоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа:
Вторичная ФМН-зависимая НАДН-дегидрогеназа − компонент дыхательной цепи, переносящий электроны от НАДН к более электроположительным компонентам:
Еще одна функция флавинзависимых дегидрогеназ − катализируемое дигидролипоилдегидрогеназой дегидрирование восстановленного липоата
(промежуточного продукта при окислительном декарбоксилировании пирувата и a-кетоглутарата). При этом вследствие низкого значения окислительно-восстановительного потенциала системы липоата переносчиком водорода от восстановленного липоата к НАД + является флавопротеин (ФАД).
Цитохромы за исключением цитохромоксидазы классифицируются как анаэробные дегидрогеназы. В дыхательной цепи они служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Цитохромы являются гемопротеинами, у которых атом железа переходит из состояния Fe 2+ в Fe 3+ и обратно в процессе окисления и восстановления. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b-5).
Гидропероксидазы. К их числу относятся ферменты пероксидаза и каталаза.
Пероксидаза − фермент, катализирующий окисление пероксидом водорода различных органических соединений − фенолов, аминов, аскорбиновой кислоты, цитохрома С. Пероксидаза обнаружена в растениях, молоке, лейкоцитах, тромбоцитах, а также в тканях, в которых происходит метаболизм эйкозаноидов. Фермент содержит протогем, который в отличие от гемовых групп большинства гемопротеинов слабо связан с апоферментом.
Реакция, катализируемая пероксидазой, имеет сложный характер; суммарная реакция выглядит следующим образом:
В эритроцитах глутатионпероксидаза, содержащая в качестве простетической группы селен, катализирует разложение Н2О2 и гидропероксидов липидов восстановленным глутатионом и, таким образом, защищает липиды мембран и гемоглобин от окисления пероксидами.
Каталаза − это гемопротеин, содержащий 4 гемовые группы. Наряду с пероксидазной активностью каталаза способна использовать одну молекулу Н2О2 в качестве донора электронов, а другую − в качестве акцептора электронов. В организме каталаза в основном разлагает пероксид водорода, образующийся при действии аэробных дегидрогеназ:
Каталаза содержится в крови, костном мозге, мембранах слизистых оболочек, почках и печени.
Во многих тканях, включая и печень, обнаружены микротельца − пероксисомы, которые богаты аэробными дегидрогеназами и каталазой. Биологически выгодно группировать в одном месте как ферменты, приводящие к образованию Н2О2, так и ферменты, разлагающие это соединение.
К ферментам, катализирующим образование Н2О2, кроме пероксисомных ферментов, относятся также митохондриальные и микросомные системы транспорта электронов.
Ферменты этой группы катализируют включение кисло-рода в молекулу субстрата, которое происходит в две стадии:
1) кислород связывается с активным центром фермента;
2) происходит реакция, в результате которой, связанный кислород восстанавливается или переносится на субстрат.
Оксигеназы не относятся к ферментам, которые катализируют реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов, токсинов и ксенобиотиков. Оксигеназы подразделяются на 2 подгруппы.
Монооксигеназы (гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для чего необходим дополнительный донор электронов (косубстрат):
Природа косубстрата может быть различной. Многие оксигеназы используют НАДФН2. В этом случае суммарное уравнение реакции можно записать как
К подобным системам относятся микросомные цитохром-Р-450-содержащие монооксигеназные системы, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе с цитохромом Р-450 и цитохромом b-5. Восстановителями этих цитохромов являются НАДН и НАДФН. Цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл:
Лек — лекарственное вещество
К лекарственным веществам, метаболизм которых идет при участии рассматриваемых систем, относятся, например, морфин и бензпирен. Многие лекарственные вещества (например, фенобарбитал) способны индуцировать синтез микросомных ферментов и цитохрома Р-450. Цитохром Р-450 является одновременно гемо- и флавопротеином, причем флавиновые нуклеотиды выступают в качестве второго донора электронов. Цитохром Р-450 в печени осуществляет гидроксилирование липофильных соединений, образующихся в качестве побочных продуктов или попадающих в организм извне (такие вещества объединяют под общим названием «ксенобиотики»). Введение в их молекулы гидроксильных групп повышает гидрофильность этих веществ, понижает токсичность и облегчает их вывод из организма.
Другой пример подобных систем − митохондриальные цитохром-Р-450-содержащие монооксигеназные системы. Они находятся в коре надпочечников, семенниках, яичниках, плаценте, почках и участвуют в биосинтезе стероидных гормонов из холестерина, катализируют гидроксилирование гидроксихолекальциферола, что приводит к образованию активной формы витамина D3 (1,25-дигидроксихолекальциферола). В коре надпочечников содержание митохондриального цитохрома Р-450 в 6 раз выше, чем содержание цитохромов в дыхательной цепи.
Диоксигеназы (истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
Примером служат железосодержащие ферменты 1.13.11.5 гомогентизатдиоксигеназа и 1.13.11.6 3-гидроксиантранилатдиоксигеназа, а также некоторые гемсодержащие ферменты, в частности триптофандиоксигеназа (триптофанпирролаза).
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9312 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Никотинамиддинуклеотид ( НАД + ), никотинамидинуклеотидфосфат ( НАДФ + )
Динуклеотиды НАД + , НАДФ + были открыты в исследованиях всемирно известных биохимиков О.Г. Варбурга, Г. фон Эйлера, Ф. Шленка в 1935-1936 гг. Коферменты НАД + , НАДФ + состоят из двух нуклеотидов, образованных никотинамидом и аденином , связанных с рибофуранозой N-β-гликозидной связью
Оба нуклеотида связаны посредством ангидридной связи между двумя фосфатами – эта связь имеет характер макроэргической.
В организме человека известно более 150 ферментов оксидоредуктаз (дегидрогеназ )в составе которых находятся НАД + , НАДФ + . Биологические функции НАД + и НАДФ + имеют отличия: роль НАД + связана в большей степени с энергетическими процессами в клетке, а НАДФ + — с реакциями пластического обмена.
На рисунках представлены : окисленная форма кофермента НАД + и восстановленная форма кофермента НАДФН.
Сравните отличия в химическом строении пиридинового цикла окисленной и восстановленных форм, отметьте положение остатка фосфорной кислоты в НАДФН ( НАДФ + )
кофермент НАД + — окисленная форма
| кофермент НАДФН — восстановленная форма Липоевая кислота Липоевая кислота , содержащая две тиольные группы, необходима для нормального прохождения реакций цикла Кребса во всех аэробных тканях организма, высокое соднржание отмечено в печени, миокарде, почках. Используют как лекарственный препарат в профилактических целях и при заболеваниях: атеросклерозе, гепатитах, диабете, ожирении. 8 7 6 1 СН2 – СН2 –СН – (СН2 )4– СООН 8 7 6 1 | | + ФАД СН2 – СН2 –СН – (СН2 )4– СООН SH SH | | S ——— S + ФАДН2Дигидролипоевая кислота Дегидролипоевая кислота восстановленная форма — окисленная форма — 6,8- димеркаптооктановая кислота циклический Аскорбиновая кислота (витамин С) |
Аскорбиновая кислота — лактон L- гулоновой кислоты, синтезируется in vivo из глюкозы в клетках животных и растений.(Лактон- это циклический сложный эфир). Человек, некоторые приматы и морские свинки потеряли способность синтезировать аскорбиновую кислоту. Бесцветные кристаллы, растворимые в воде, имеет резкий кислый вкус. Водный раствор имеет кислую среду, с величиной рН около 3. В восстановленной форме содержит две енольные гидроксигруппы, обладающие кислотными свойствами, но действует как одноосновная кислота. Значения рКа 4.04 и 11.1( одна группа- сильная кислота, сильнее уксусной, а другая очень слабая).
Существует в двух формах: восстановленной (АК) и окисленной (дегидроаскорбиновой кислотой, ДАК), которые обратимо переходят друг в друга в окислительно-восстановительных реакциях.
Дигидроаскорбиновая кислота Дегидроаскорбиновая кислота
АК вместе с ДАК образует окислительно-восстановительную пару с редокс-потенциалом +0,139
В растворе аскорбиновая кислота может окисляться кислородом воздуха, пероксидом водорода, перманганатом калия, железом(+3) и другими окислителями.
ДАК легко восстанавливается цистеином, глутатионом, сероводородом (реакции обратимы )
Аскорбиновая кислота является природным антиоксидантом, она подавляет реакции свободно-радикального окисления. : инактивирует активные формы кислорода О2• , Н2О2, НО • в водной фазе
При кулинарной обработке пищи в присутствии окислителей и кислорода воздуха часть витамина С разрушается.
В слабощелочной среде происходят разрушение лактонового кольца и потеря биологической активности. Одним из конечных продуктов обмена ДАК в организме является щавелевая кислота.
Суточная потребностьчеловека в витамине С составляет 50—75мг.
Источники витамина С — свежие фрукты, овощи, зелень
Содержание витамина С в продуктах
Дата добавления: 2014-01-07 ; Просмотров: 976 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Поскольку окисление одного вещества (донора электронов и протонов) сопряжено с восстановлением другого соединения (их акцептора), ферменты, катализирующие эти реакции, называют оксидоредуктазами. Все они относятся к I классу ферментов:
Донор (Д) отдает электроны и протоны, акцептор (А) принимает их, а энзим (Е) осуществляет реакцию переноса. Существуют три группы оксидоредуктаз:
а) анаэробные дегидрогеназы передают электроны различным промежуточным акцепторам, но не кислороду;
б) аэробные дегидрогеназы передают электроны различным акцепторам, в том числе кислороду;
в) оксидазы способны передавать электроны только кислороду.
Анаэробные дегидрогеназы. Это двухкомпонентные ферменты, коферментом которых может быть НАД + (никотинамидадениндинуклеотид):
При окислении субстрата НАД + превращается в восстановленную форму НАДH, а второй протон субстрата диссоциирует в среду (НАДH + Н + ). К анаэробным НАД-зависимым дегидрогеназам относятся такие ферменты, как алкогольдегидрогеназа, лактатдегидрогеназа, малатдегидрогеназа и др. Коферментом анаэробных дегидрогеназ может быть также НАДФ + (никотинамидадениндинуклеотидфосфат), содержащий на одну фосфатную группировку больше, чем НАД + . НАДФ- зависимыми дегидрогеназами являются изоцитратдегидрогеназа, глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа и др.
Субстратная специфичность фермента зависит от его белковой части. Многие НАД- и НАДФ-зависимые дегидрогеназы нуждаются в присутствии ионов двухвалентных металлов. Например, алкогольдегидрогеназа содержит ионы цинка.
Окисленные и восстановленные формы коферментов анаэробных дегидрогеназ могут взаимопревращаться в реакции, катализируемой ферментом НАД(Ф)-трансгидрогеназой:
Анаэробные дегидрогеназы передают водород, т. е. электроны и протоны, различным промежуточным переносчикам и аэробным дегидрогеназам.
Аэробные дегидрогеназы. Это также двухкомнонентные ферменты, получившие название флавиновых (флавопротеины).
Помимо белков, в их состав входит прочно связанная с ними простетическая группа — рибофлавин (витамин В2).
Различают два кофермента этой группы: флавинмононуклеотид (ФМН), или желтый дыхательный фермент Варбурга, и флавинадениндинуклеотид (ФАД).
ФМН (рибофлавин-5-фосфат) содержит гетероциклическое азотистое основание — диметилизоаллоксазин, спирт рибит (производное рибозы) и фосфат:
В ФАД кроме ФМН имеется еще один нуклеотид — аденозинмонофосфата:
Активной группой в реакции присоединения и отдачи электронов и протонов в ФМН и ФАД служит изоаллоксазин. Взаимодействие с восстановленным переносчиком, например НАДH, происходит следующим образом:
Примером дегидрогеназы, в состав которой входит ФАД, является сукцинатдегидрогеназа. Доноры электронов для аэробных дегидрогеназ — анаэробные дегидрогеназы, а акцепторы — хиноны, цитохромы, кислород.
Цитохромная система. Среди оксидаз очень важную роль играют железосодержащие ферменты и переносчики, относящиеся к цитохромной системе. В нее входят цитохромы » и цитохромоксидаза. Включаясь в определенной последовательности в процесс переноса электронов, они передают их от флавопротеинов на молекулярный кислород.
Все компоненты цитохромной системы содержат железопорфириновую простетическую группу.
При переносе электронов цитохромами железо обратимо окисляется и восстанавливается, отдавая или приобретая электрон и изменяя таким образом свою валентность. В дыхательной цепи направление транспорта электронов определяется величиной окислительно-восстановительного потенциала цитохромов.
В этой системе передавать электроны непосредственно на кислород способна только цитохромоксидаза (цит. а + а3). Из всех известных оксидаз она имеет наибольшее сродство к кислороду. Ингибиторами цитохромоксидазы являются СО, цианид, азид. Б растительных митохондриях кроме цитохромоксидазы функционирует оксидаза, не подавляемая цианидом и названная альтернативной оксидазой. Например, в митохондриях початков ароидных активность цианидустойчивой оксидазы в 10 раз превышает активность цитохромоксидазы.
Пероксидаза и каталаза. К пероксидазам относят целую группу ферментов, использующих в качестве окислителя пероксид водорода: классическую пероксидазу, НАД-пероксидазу, НАДФ-пероксидазу, пероксидазу жирных кислот, глутатионпероксидазу, цитохромпероксидазу и др. Все они работают по следующей схеме, где А — субстраты:
В последние 2 — 3 десятилетия показана полифункциональность пероксидаз. Помимо пероксидазной, у них имеется оксидазная функция, т. е. способность переносить электроны в отсутствие пероксидного кислорода на молекулярный кислород. Пероксидаза может также функционировать как анаэробная дегидрогеназа, например НАДH-дегидрогеназа, передающая электроны от восстановленных пиридиновых нуклеотидов на разные акцепторы.
Пероксид водорода, помимо пероксидазы, расщепляется также каталазой, в результате чего образуется молекулярный кислород. В реакции участвуют две молекулы пероксида, одна из которых функционирует как донор, а другая — как акцептор электронов.
Простетической группой пероксидазы и каталазы служит гем, в состав которого входит атом железа.
Оксигеназы. Наряду с оксидазами, которые используют молекулярный кислород как акцептор электронов, в клетках широко представлены оксигеназы, активирующие кислород, в результате чего он может присоединяться к органическим соединениям. Ферменты, внедряющие в субстрат два атома кислорода, называют диоксигеназами, а присоединяющие один атом кислорода — монооксигеназами или гидроксилазами. В качестве доноров электронов оксигеназы используют НАД(Ф)H, ФАДH2 и др.
Оксигеназы присутствуют во всех типах клеток. Они участвуют в гидроксилировании многих эндогенных соединений в частности аминокислот, фенолов, стеринов и др., а также в детоксикации чужеродных токсических веществ (ксенобиотиков).
Механизмы участия кислорода в метаболизме, активные формы кислорода и их значение в жизнедеятельности растительной клетки, эволюция энзиматических систем, участвующих во взаимодействии клеток с кислородом.
Эволюция энзиматических систем, участвующих во взаимодействии клеток с кислородом»
У современных организмов представлены 3 типа энергообмена − фотосинтез, дыхание, брожение.
Согласно принятым в настоящее время представлениям материальным и энергетическим фундаментом становления жизни на нашей планете служили органические соединения, возникшие из неорганических абиогенным путем. Теорией А.И.Опарина основано представление, согласно которому первичными формами живых существ были гетеротрофы, осуществляющие свой энергообмен анаэробным путем, по своему характеру относящимся к броженияю. Современные анаэробы гетеротрофы располагают каталитически активными системами энергообмена, включая дегидрогеназы, изомеразы, трансферазы, системы синтеза АТФ и др.
Следующим этапом развития биоэнергетики явилась фототрофность, которая была неразрывно связана с образованием каталитических систем принципиально нового типа − пигментов, обладающих способностью использовать поглощенные кванты света для перехода в состояние электронного возбуждения. Преобразование энергии свободного электрона в химическую достигалась при участии новой каталитической системы, организованной в цепь транспорта электронов.
Начальным звеном в эволюции фототрофности были фототрофные бактерии, способные в качестве доноров электронов использовать только высоковосстановленные соединения с низким окислительным потенциалом. Общей особенностью дошедших донас фотосинтезирующих бактерий явялется то, что система транспорта электронов у них включает цитохромы, флавиновые ферменты, хиноны, электронный поток сопряжен с фосфорелированием. Восстановление НАД осуществляется у бактерий в основном за счет АТФ, т.е. не фотохимическим, а биохимическим путем.
В дальнейшем ходе эволюции возникли организмы, обладающие механизмами мобилизации электронов от предельно окисленной формы водорода, в какой он находится в молекуле Н2О. Такими организмами являются зеленые растения, обладающие способностью к прямому восстановлению НАДФ.
Появление свободного кислорода в результате фотосинтеза вызвало неизбежность создания и отбора механизмов дезактивации кислорода путем его восстановления, что привело к переходу от анаэробного типа обмена к аэробному. При формировании каталитических систем дыхания были широко использованы элементы уже ранее существовавших механизмов ЭТЦ фотосинтетиков. Цепь переноса дыхания можно представить как освобожденную от сопряжения с пигментами ЭТЦ фотосинтеза.
источник