Кофермент — дополнительная группа, легко отделяемая от апофермента при диссоциации. Предполагают, что простетическая группа может быть связана с белком ковалентными и нековалентными связями. С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми. В таких случаях при выделении ферментов наблюдается полная диссоциация обеих частей, и белковый компонент лишается ферментативной активности. Типичными представителями являются витамины В1, В2, В6, РР, содержащие коферменты.
Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни К коферментам, ни к простетическим группам.
Условно можно выделить две функции кофакторов:
1. участие в каталитическом превращении субстрата одним ферментным белком. При этом кофактор может функционировать либо как катализатор, который регенерируется после каждого акта превращения субстрата, либо как косубстрат. В последнем случае регенерация исходной формы кофермента осуществляется другим ферментом в сопряжённой реакции.
2. Активация и перенос молекулы субстрата от одного фермента к другому. В этом варианте субстрат реагирует с коферментом в активном центре фермента так, что образуется новое реакционноспособное производное субстрата, которое устойчиво в водной среде. Затем образовавшееся производное субстрата связывается с другим ферментом, в активном центре которого и осуществляется каталитическое превращение субстрата с одновременной регенерацией кофактора.
17. Классификация коферментов по строению и функциям.
По строению:
—Алифатические (липоевая кислота)
— ароматические (коэнзим Q)
— гетероциклические (ТПФ, ПФ)
— нуклеотиды (НАД, НАДФ, ФАД, ФМН)
По функциям:
—переносчики протонов и электронов (НАД,ФАД. Ко Q)
—переносчики Групп (ТПФ,ПФ,Ко А)
— коферменты синтеза и изомеризации.
НАД и НАДФ, строение ок-й и вос-ой форм, участвующих в катализе.
Производные PP витамина. Биохимическая функция: дыхание, перенос водорода. Витамин РР входит в состав НАД или НАДФ, являющихся коферментами большого числа обратимо действующих в ОВР дегидрогеназ. Показано, что ряд дегидрогеназ использует только НАД и НАДФ (соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа), другие могут катализировать ОВР в присутствии любого из них (например, глутаматдегидрогеназа). В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами.
Производные витамина B2.Биологическая функция дыхание, перенос водорода. Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД, являющихся простетическими группами ферментов флавопротеинов. Некоторые флавопротеины в дополнение к ФМН или ФАД содержат еще прочно связанные неорганические ионы, в частности железо или молибден, наделенные способностью катализировать транспорт электронов. Различают 2 типа химических реакций, катализируемых этими ферментами. К первому относятся реакции, в которых фермент осуществляет прямое окисление с участием кислорода, т.е. дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы L- и D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др. Вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов. Ферменты этой группы играют главную роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый остаток ФАД или ФМН подвергается обратимому восстановлению с присоединением электронов и атомов водорода к N1 и N10. ФМН синтезируется в организме животных из свободного рибофлавина и АТФ при участии специфического фермента рибофлавинкиназы: Образование ФАД в тканях также протекает при участии специфического АТФ-зависимого фермента ФМН-аденилилтрансферазы.
20. КОА, строение, роль.
Витамин В3, транспорт ацильных групп. Пантотеновая кислота входит в состав кофермента А, или коэнзима А (КоА). Название ≪коэнзим А≫ (кофермент ацилирования) связано с тем, что это соединение участвует в ферментативных реакциях, катализирующих как активирование, так и перенос ацетильного радикала СН3СО; позже оказалось, что КоА активирует и переносит также другие кислотные остатки (ацилы). Участвует в обмене веществ, в основных биохимических процессах, окисление и биосинтез высших жирных кислот, окислительное декарбоксилирование α-кетокислот, биосинтез фосфолипидов, стероидных гормонов, гема и гемоглобина, ацетилхолина и др.
Последнее изменение этой страницы: 2017-01-24; Нарушение авторского права страницы
источник
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н + ]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn 2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu 2+ — амилазы, Mg 2+ — АТФ-азы (например, миозиновой АТФ-азы).
-присоединении субстратного комплекса фермента;
-стабилизация оптимальной конформации активного центра фермента;
-стабилизация четвертичной структуры.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Как то на паре, один преподаватель сказал, когда лекция заканчивалась — это был конец пары: «Что-то тут концом пахнет». 8363 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Коферменты в каталитических реакциях осуществляют транспорт различных групп атомов, электронов или протонов. Коферменты связываются с ферментами:
— гидрофобными взаимодействиями и т.д.
Один кофермент может быть коферментом для нескольких ферментов. Многие коферменты являются полифункциональными (например, НАД, ПФ). В зависимости от апофермента зависит специфичность холофермента.
Все коферменты делят на две большие группы: витаминные и невитаминные.
Коферменты витаминной природы– производные витаминов или химические модификации витаминов.
1 группа: тиаминовые – производные витамина В1. Сюда относят:
— тиаминдифосфат (ТДФ) или тиаминпирофосфат (ТПФ) или кокарбоксилаза;
ТПФ имеет наибольшее биологическое значение. Входит в состав декарбоксилазы кетокислот: ПВК, a-кетоглутаровая кислота. Этот фермент катализирует отщепление СО2.
Кокарбоксилаза участвует в транскетолазной реакции из пентозофосфатного цикла.
2 группа: флавиновые коферменты, производные витамина В2. Сюда относят:
Ребитол и изоалоксазин образуют витамин В2. Витамин В2 и остаток фосфорной к-ты образуют ФМН. ФМН в соединении с АМФ образуют ФАД.
[рис. изоалоксазиновое кольцо соединено с ребитолом, ребитол с фосфорной к-той, а фосфорная к-та – с АМФ]ФАД и ФМН являются коферментами дегидрогеназ. Эти ферменты катализируют отщепление от субстрата водорода, т.е. участвуют в реакциях окисления–восстановления. Например СДГ – сукцинатдегидрогеназа – катализирует превращение янтарной к-ты в фумаровую. Это ФАД-зависимый фермент. [рис. COOH-CH2-CH2-COOH® (над стрелкой – СДГ, под – ФАД и ФАДН2) COOH-CH=CH-COOH]. Флавиновые ферменты (флавинзависимые ДГ) содержат ФАД, который в них является первоисточником протонов и электронов. В процессе хим. реакций ФАД превращается в ФАДН2. Рабочей частью ФАД является 2 кольцо изоалоксазина; в процессе хим. реакции идет присоединение двух атомов водорода к азотам и перегруппировка двойных связей в кольцах.
3 группа: пантотеновые коферменты, производные витамина В3 – пантотеновой кислоты. Входят в состав кофермента А, НS-КоА. Этот кофермент А является коферментом ацилтрансфераз, вместе с которой переносит различные группировки с одной молекулы на другую.
4 группа: никотинамидные, производные витамина РР — никотинамида:
Коферменты НАД и НАДФ являются коферментами дегидрогеназ (НАДФ-зависимых ферментов), например малатДГ, изоцитратДГ, лактатДГ. Участвуют в процессах дегидрирования и в окислительно-восстановительных реакциях. При этом НАД присоединяет два протона и два электрона, и образуется НАДН2.
Рис. рабочей группы НАД и НАДФ: рисунок витамина РР, к которому присоединяется один атом Н и в результате происходит перегруппировка двойных связей. Рисуется новая конфигурация витамина РР + Н + ]
5 группа: пиридоксиновые, производные витамина В6. [рис. пиридоксаля. Пиридоксаль+ фосфорная к-та= пиридоксальфосфат]
Эти формы взаимопревращаются в процессе реакций. При взаимодействии пиридоксаля с фосфорной кислотой получается пиридоксальфосфат (ПФ).
ПФ является коферментом аминотрансфераз, осуществляет перенос аминогруппы от АК на кетокислоту – реакция переаминирования. Также производные витамина В6 входят как коферменты в состав декарбоксилаз АК.
Коферменты невитаминной природы – вещества, которые образуются в процессе метаболизма.
1) Нуклеотиды – УТФ, УДФ, ТТФ и т.д. УДФ-глюкоза вступает в синтез гликогена. УДФ-гиалуроновая к-та используется для обезвреживания различных веществ в трансверных реакциях (глюкоуронил трансфераза).
2) Производные порфирина (гем): каталаза, пероксидаза, цитохромы и т.д.
3) Пептиды. Глутатион – это трипептид (ГЛУ-ЦИС-ГЛИ), он участвует в о-в реакциях, является коферментом оксидоредуктаз (глутатионпероксидаза, глутатионредуктаза). 2GSH«(над стрелкой 2Н) G-S-S-G. GSH является восстановленной формой глутатиона, а G-S-S-G – окисленной.
4) Ионы металлов, например Zn 2+ входит в состав фермента АлДГ (алкогольдегидрогеназы), Cu 2+ — амилазы, Mg 2+ — АТФ-азы (например, миозиновой АТФ-азы).
-присоединении субстратного комплекса фермента;
-стабилизация оптимальной конформации активного центра фермента;
источник
Дегидрогеназы – ферменты класса оксидоредуктаз (пиридинзависимые, флавинзависимые, аэробные и анаэробные типы, физиология, биохимия)
Дегидрогеназы представляют собой энзимы класса оксидоредуктаз, которые катализируют реакции отщепления водорода (то есть протонов и электронов) от субстрата, который является окислителем, и транспортируют его на другой субстрат, который восстанавливается.
В зависимости от химической природы акцептора, с которым взаимодействуют дегидрогеназы, их делят на несколько групп:
- Анаэробные дегидрогеназы, которые катализируют реакции, в которых акцептором водорода является соединение, которое отличается от кислорода.
- Аэробные дегидрогеназы, которые катализируют реакции где акцептором водорода может быть кислород (оксидазы) или другой акцептор. Аэробные дегидрогеназы относятся к флавопротеинам, продукт реакции — перекись водорода.
- Дегидрогеназы, которые обеспечивают транспортировку электронов от субстрата к акцептору электронов. К этой группе дегидрогеназ принадлежат цитохромы дыхательной цепи митохондрий.
- Дегидрогеназы, которые катализируют прямое введение в молекулу субстрата окисляется, 1 или 2 атомов кислорода. Такие дегидрогеназы получили название оксигеназы.
Функцию первичных акцепторов атомов водорода, отщепляющихся от соответствующих субстратов, выполняют дегидрогеназы 2 типов:
- пиридинзависимые дегидрогеназы — содержат коферменты никотинамид (НАД +) или никотинамидадениндинуклеотидфосфат (НАДФ +).
- флавинзависимые дегидрогеназы, простетической группой которых является флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (ФМН).
Коферменты НАДФ+ (или НАД+) с апоферментом связаны непрочно и поэтому могут в клетке находиться как в связанном с апоферментом состоянии, так и быть отделенными от белковой части.
Пиридинзависимые дегидрогеназы относятся к анаэробному типу — водорастворимые ферменты, окисляющие полярные субстраты. Реакции, катализируемой пиридинзависимыми дегидрогеназами, в общем виде приведены в таких уравнениях:
Рабочей структурой в молекуле НАД + или НАДФ + является пиридиновое кольцо никотинамид, который присоединяет в ходе ферментативной реакции один атом водорода и один электрон (гидрид-ион), а второй протон поступает в реакционную среду. Пиридинзависимые дегидрогеназы очень распространены в живых клетках. Они отщепляющие протоны и электроны от многих субстратов, восстанавливая НАД + или НАДФ + и передавая в дальнейшем восстановительные эквиваленты на другие акцепторы. НАД-зависимые дегидрогеназы главным образом катализируют окислительно-восстановительные реакции окислительных путей метаболизма — гликолиза, цикла Кребса, β-окисления жирных кислот, дыхательной цепи митохондрий и др. НАД является главным источником электронов для цепи переноса электронов. НАДФ используется главным образом в процессах восстановительного синтеза (в синтезе жирных кислот и стероидов).
Флавинзависимые дегидрогеназы — флавопротеины, простетическими группами в которых ФАД или ФМН — производные витамина В2, которые прочно (ковалентно) связаны с апоферментом. Данные дегидрогеназы — мембраносвязанные ферменты, окисляющие неполярные и малополярные субстраты. Рабочей частью молекулы ФАД или ФМН, которая участвует в окислительно-восстановительных реакциях, является изоалоксазиновое кольцо рибофлавина, который акцептирует два атома водорода (2Н+ + 2е-) от субстрата.
Общее уравнение реакции с участием флавинзависимых дегидрогеназ выглядит так:
В процессах биологического окисления данные ферменты играют роль как анаэробных, так и аэробных дегидрогеназ. К, анаэробным дегидрогеназам принадлежит НАДН-дегидрогеназа, ФМН-зависимый фермент, который передает электроны от НАДН на более электроположительны компоненты дыхательной цепи митохондрий. Другие дегидрогеназы (ФАД-зависимые) переносят электроны непосредственно от субстрата на дыхательную цепь (например, сукцинатдегидрогеназа, ацил-КоА-дегидрогеназа). Транспортировка электронов от флавопротеинов к цитохромоксидазам в дыхательной цепи обеспечивают цитохромы, которые, кроме цитохромоксидазы, по классификации как анаэробные дегидрогеназы. Цитохромы – представляют собой железосодержащие протеины митохондрий — гемпротеины, которые за счет обратного изменения валентности геминового железа выполняют функцию транспортировки электронов в аэробных клетках непосредственно в цепях биологического окисления: цитохром (Fe3 +) + е → цитохром (Fe2 +).
В состав дыхательной цепи митохондрий входят цитохромы b, с1, с, а и а3 (цитохромоксидаза). Кроме дыхательной цепи, цитохромы содержатся в эндоплазматическом ретикулуме (450 и b5). К аэробным флавинзависимым дегидрогеназам принадлежат оксидазы L-аминокислот, ксантиноксидаза и др.
Дегидрогеназы, катализируют включение одного или двух атомов кислорода в молекулу субстрата, получили название оксигеназы. В зависимости от количества атомов кислорода, которые взаимодействуют с субстратом, оксигеназы делят на 2 группы:
Диоксигеназы катализируют присоединяет в молекулу субстрата 2 атомов кислорода: S + O2 → SO2. Это, в частности, негемовые железосодержащие ферменты, катализирующие реакции синтеза гомогентизиновой кислоты и ее окисления на пути катаболизма тирозина. Железосодержащая липооксигеназа катализирует включение О2 в арахидоновую кислоту, первую реакцию в процессе синтеза лейкотриенов. Пролин- и лизиндиоксигеназы катализируют реакции гидроксилирования остатков лизина и пролина в проколлагене. Монооксигеназы катализируют присоединение к субстрату только 1 из атомов молекулы кислорода. При этом, второй атом кислорода восстанавливается до воды:
К монооксигеназам принадлежат ферменты, которые участвуют в обмене веществ многих лекарственных субстанций путем их гидроксилирования. Эти ферменты имеют локализацию преимущественно в микросомальной фракции печени, надпочечников, половых желез и других тканей. Поскольку чаще всего субстрат в монооксигеназных реакциях гидроксилируется, данную группу энзимов также называют гидроксилазы.
Монооксигеназы катализируют реакции гидроксилирования холестерина (стероидов) и превращение их в биологически активные субстанции, в том числе — половые гормоны, гормоны надпочечников, активные метаболиты витамина D — кальцитриол, а также реакции детоксикации путем гидроксилирования ряда токсичных веществ, лекарственных средств и продуктов их превращения для организма. Монооксигеназная мембранная система эндоплазматического ретикулума гепатоцитов содержит НАДФН + Н+, флавопротеины с кофактором ФАД, протеин (адренотоксин), содержащий негемовое железо, и гемпротеин — цитохром Р450. В результате гидроксилирования неполярных гидрофобных субстанций повышается их гидрофильность, что способствует инактивации биологически активных веществ или обезвреживанию токсичных субстанций и экскреции их из организма. Некоторые лекарственные субстанции, такие, как фенобарбитал, имеют способность индуцировать синтез микросомальных ферментов и цитохрома Р450.
Существуют монооксигеназы, которые не содержат цитохрома Р450. К ним относятся ферменты печени, которые катализируют реакции гидроксилирования фенилаланина, тирозина, триптофана.
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
источник
Первый тип переносчиков электронов и протонов (ферментов дегидрогеназ) в дыхательной цепи представлен никотинамидными коферментами — НАД(никотинамидадениндинуклеотид) иНАДФ (никотинамидадениндинуклеотидфосфат). Они состоят из: азотистых оснований – амида никотиновой кислоты (витамин В5) и аденина, двух углеводных компонентов – Д-рибозы, двух остатков фосфорной кислоты. НАДФ отличается от НАД наличием еще одной фосфатной группы у 2-го атома углерода аденилового нуклеотида.
Известно более 150 дегидрогеназ, коферментами которых являются НАД или НАДФ. Эти дегидрогеназы называются пиридинзависимыми, поскольку содержат никотинамид – производное пиридина. НАД и НАДФ обнаруживаются во всех типах клеток, причем НАД содержится в значительно больших количествах по сравнению с НАДФ. Дегидрогеназы, связанные с НАД, принимают участие, главным образом, в процессе дыхания (т.е. в переносе протонов и электронов от субстратов к кислороду), тогда как дегидрогеназы, связанные с НАДФ, участвуют преимущественно в переносе протонов и электронов от субстратов к восстановительным реакциям биосинтеза.
Механизм действия НАД и НАДФ.Коферменты НАД и НАДФ работают в клетке только вместе с белковой частью, образуя сложные ферменты дегидрогеназы. Специфичность связывания коферментов НАД и НАДФ с ферментами-белками зависит от адениннуклеотидной части их молекул, в то время как никотинамидная часть этих молекул осуществляет перенос электронов и протонов от окисляемого субстрата. Пиридиновое кольцо никотинамида имеет положительный заряд у четвертичного атома азота (поэтому окисленную форму НАД записывают в виде НАД + ). Это вызывает смещение электронной плотности в пиридиновом кольце и появление положительного заряда у атома углерода в параположении. К нему присоединяется гидрид-ион (Н — ), образующийся при неравномерном распределении электронов между атомами водорода: 2Н = Н — + Н + . Другой атом водорода, потерявший электрон (Н + ), освобождается в окружающую среду, подкисляя ее. В результате образуется восстановленная форма НАД, записываемая в виде НАД . 2Н или НАД . Н+Н + .
Дегидрогеназные реакции с участием в качестве коферментов НАД и НАДФ имеют ряд характерных особенностей, которые обусловливают их ключевую роль в процессах биологического окисления. Первая особенность дегидрогеназных реакций — их легкая обратимость при небольших изменениях свободной энергии, что позволяет коферментам участвовать как в окислении субстрата, так и в восстановлении продуктов реакции (в зависимости от потребностей клетки). Вторая особенность заключается в способности этих коферментов (как в окисленной, так и в восстановленной форме) легко отделяться от белка-носителя, их высокой подвижности, что облегчает обмен атомами водорода и электронами между различными дегидрогеназными системами, расположенными в разных частях клетки. Коферменты НАД и НАДФ способны акцептировать водород от большого числа субстратов, окислительно-восстановительный потенциал которых ниже -0,3 В. К числу таких субстратов относятся продукты расщепления углеводов, жиров и различных аминокислот.
В дыхательной цепи ферментов пиридинзависимые дегидрогеназы передают атомарные водороды другим переносчикам — флавиновым ферментам.
Флавиновые ферменты– это сложные ферменты, небелковая часть которых представлена простетическими группами ФМН (флавинаденинмононуклеотид) или ФАД (флавинадениндинуклеотид).
ФМН состоит из изоаллоксазинового кольца, спирта рибитола (вместе они образуют витамин В2 – рибофлавин) и фосфорной кислоты, ФАД содержит дополнительно адениловый нуклеотид. Молекулярная структура ФАД имеет вид:
В отличие от никотинамидных коферментов ФМН и ФАД прочно (ковалентно) связываются с соответствующими дегидрогеназными белками и не отщепляются ни на одной из стадий каталитического процесса. Реакции, катализируемые флавинзависимыми дегидрогеназами, трудно обратимы, и, следовательно, флавиновые коферменты не могут служить источником водородных атомов в процессах восстановительного биосинтеза, подобно никотинамидным коферментам.
Механизм действия ФМН и ФАД.Активной частью молекулы ФАД или ФМН служит изоаллоксазиновое кольцо рибофлавина. Два атома водорода (два протона и два электрона) присоединяются к первому и десятому атомам азота за счет внутримолекулярной перегруппировки двойных связей в кольце. Реакция восстановления ФМН имеет вид:
Окисленная форма ФМН Восстановленная форма ФМН . 2Н
В соответствии с более положительными величинами окислительно-восстановительных потенциалов, чем у никотинамидных коферментов (около — 0,1 В), флавопротеиды могут акцептировать водород от НАД . 2Н:
НАД . 2Н + ФМН = НАД + + ФМН . 2Н.
Именно этот процесс протекает в дыхательной цепи ферментов на внутренней мембране митохондрий.
В некоторых случаях, например при окислении янтарной кислоты, α-глицерофосфата и КоА-производных жирных кислот, флавинзависимые ферменты могут играть роль первичных дегидрогеназ и непосредственно принимать электроны и протоны от окисляемых субстратов без участия НАД и связанных с ним дегидрогеназ.
В клетках также имеются аэробные флавиновые ферменты, осуществляющие перенос атомов водорода от субстрата к кислороду с образованием Н2О2.
Третий тип переносчиков электронов в дыхательной цепи представлен бензохиноновым соединением, носящим название кофермента Q или убихинон. Производное бензохинона имеет длинную изопреноидную цепь (для микроорганизмов n=6, для эукариот – 9). Убихинон свободно перемещается в липидной части внутренней мембраны митохондрий, и его быстрой диффузии способствует длинный неполярный хвост.
Механизм действия КоQ.При восстановлении убихинон, подобно флавиновым коферментам, присоединяет электроны и протоны. Он способен к одно- и двухэлектронному переносу, превращаясь в первом случае в полухинон КоQ . Н (семихинон), во втором в гидрохинон КоQ . 2Н.
Полухинон (КоQ . Н) Гидрохинон (КоQ . 2Н)
Кофермент Q имеет величину окислительно-восстановительного потенциала более положительную, чем у флавопротеидов (+0,02 В). В дыхательной цепи ферментов убихинон способен принимать водород от различных флавопротеидов:
ФМН . 2Н + КоQ = ФМН + КоQ . 2Н.
Система КоQ представляет собой узловой пункт, куда стекается водород, поступающий в дыхательную цепь от самых различных субстратов. Поэтому КоQ в дыхательной цепи представлен в более высоких концентрациях, чем большинство других переносчиков электронов. Хорошая растворимость в липидной фазе мембранных образований и относительно небольшой молекулярный вес придают коферменту свойство подвижного переносчика, взаимодействующего с фиксированными электронпереносящими белками.
Четвертый тип переносчиков электронов в дыхательной цепи от КоО. на кислород представлен группой различных гемосодержащих белков (гемопротеидов), называемых цитохромами. Отличаясь друг от друга структурой белкового компонента, все они имеют простетическую геминовую группу, близкую по своему строению к гему гемоглобина. В центре порфиринового кольца каждого тема находится ион железа. Группы цитохромов а, b и с отличается между собой сторением апофермента, строением простетической группы, характером связи между простетической группой и апоферментом.
Простетическая группа цитохрома с
Механизм действия цитохромов. В отличие от флавопротеидов, которые функционируют одновременно, перенося водород от различных субстратов на общий акцептор КоQ, цитохромы действуют последовательно, перенося электроны от КоQ на конечный акцептор — кислород. На участке дыхательной цепи между НАД и КоQ осуществляется двухэлектронный перенос, тогда как цитохромы, действующие на участке между КоQ и кислородом, переносят лишь по одному электрону. При этом происходит обратимое окисление-восстановление атома железа простетической группы, переходящего из Fе 2+ в Fе 3+ . Следовательно, на данном участке дыхательной цепи должны действовать две молекулы цитохромов.
В соответствии с величиной окислительно-восстановительного потенциала у разных цитохромов они располагаются в определенной последовательности в дыхательной цепи между КоQ и кислородом:
цит. b> цит. с1> цит. с > цит. а > цит. а3 > О2
+ 0,03 В +0,22В +0,24 В +0,25 В +0,39 В +0,82 В
В этой же последовательности происходит перенос электронов.
Переносчиком электронов во всех цитохромах (а, b, с) является железо, однако оно не способно отдавать электроны кислороду. Такой способностью обладает медь, которая принимает электроны от Fe в цитохроме а3 (цитохромоксидазный комплекс). Поэтому завершающей является реакция, катализируемая ферментом-цитохромоксидазой — сложным гемопротеидом, состоящим из 7полипептидных цепей, двух различных гемов, которые обозначаются как цитохромы а и а3, и двух атомов меди, принимающих участие в транспорте электронов: Сu 2+ + е =Сu + .
Первый из цитохромов на этом участке — цитохром а — реагирует с цитохромом с, принимает электроны и переносит их на цитохром а3, содержащий ионы меди, который способен прямо взаимодействовать с кислородом как конечным акцептором электронов.
«Активный» кислород присоединяет два протона из окружающей среды, образуя воду. В этой реакции кислород, как наиболее сильный окислитель, акцептируя электроны, создает основную движущую силу для переноса электронов вдоль дыхательной цепи. Кислород обеспечивает отток электронов из дыхательной цепи, в результате чего все выше расположенные переносчики поддерживаются в окисленном состоянии и оказываются способными принимать водород и электроны, поставляемые от окисляемых субстратов.
На различных участках дыхательной цепи наряду с названными основными переносчиками (флавопротеидами, КоQ и цитохромами) в транспорте электронов принимают участие белки, содержащие негеминовое железо, в молекуле которых железо связывается с белком-носителем через атом серы.
Обычно реакции окисления, связанные с отщеплением водорода от молекул органических субстратов при участии НАД или ФАД зависимых дегидрогеназ, обозначают как первичное окисление, а последовательность окислительно-восстановительных реакций в дыхательной цепи — как терминальное окисление.
Дата добавления: 2015-05-08 ; Просмотров: 5900 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов.
Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике.
Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями.
Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода:
Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и р-меркаптоэтанол, содержащий SH-rpynny. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих пере-нос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жир-ных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот.
Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В, (тиа-мин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов.
Пиридоксалевые и кобаламидные коферменты являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков.
Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент.
Убихиноновые коферменты (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования.
Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТф, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов.
Свойства ферментов
Для ферментов характерны высокая каталитическая активность, специфичность действия и регулируемость их активности.
Благодаря высокой каталитической активности ферментов скорость некоторых химических реакций увеличивается в миллионы раз. Примером может служить обратимая реакция синтеза и распада угольной кислоты, которую катализирует фермент карбоангидраза: СО2 + Н2О = Н2СО3. Одна молекула карбоангидразы эритроцитов способна связывать до 105 молекул СО2 в секунду, при этом скорость реакции в присутствии фермента увеличивается в 107 раз. Реакция синтеза Н2СО3 постоянно протекает в тканях организма при связывании метаболического СО2, а реакция распада Н2СО3 интенсивно протекает в капиллярах легких, где происходит выведение СО2 из организма при выдохе.
Очень высокую активность проявляет каталаза, которая катализирует расщепление токсичного для организма вещества — перекиси водорода: 2Н2О2 -> 2Н2О + О2. При температуре 0° С одна молекула каталазы разлагает 40 000 молекул Н2О2 в секунду.
Специфичность действия ферментов состоит в том, что фермент может катализировать превращение определенного субстрата или действовать на один из типов химических связей в нем. Благодаря этому в клетке множество химических реакций протекает одновременно в строго определенном порядке. Различают ферменты с абсолютной, относительной и групповой специфичностью. Абсолютная специфичность фермента проявляется в том, что он катализирует превращение молекул только одного субстрата. Например, фермент аргиназа способен катализировать распад только аргинина на мочевину и орнитин, а ферменты сахараза, мальтаза, лактаза способны расщеплять только соответствующие дисахариды. Относительной специфичностью действия обладают ферменты, которые катализируют разрыв определенного типа химической связи в молекулах разных веществ. Для них строение молекулы субстрата не имеет решающего значения. Относительная специфичность характерна для пептидаз пищеварительного тракта (пепсина, трипсина, химотрипсина), которые расщепляют пептидную связь в различных белках и пептидах, а также фосфатаз, липаз, которые расщепляют эфирные связи в молекулах различных веществ. Ферменты действуют только на один из нескольких изомеров субстрата. Групповая специфичность характерна для ферментов, которые действуют на субстраты с одинаковым типом связи и подобным строением молекул. Так, например, холинэстеразы расщепляют эфирную вязь во многих субстратах, которые содержат остаток холина.
Регуляция процессов синтеза ферментов осуществляется на уровне генов и на уровне транскрипции (синтеза иРНК). Такие изменения наблюдаются при долговременном воздействии различных факторов среды, физических нагрузок и стероидных гормонов.
Процессы адаптации организма к физическим нагрузкам взаимосвязаны с совершенствованием различных механизмов регуляции активности ферментов. При срочной адаптации к физическим нагрузкам изменяется активность уже существующих ферментов. При долговременной адаптации в организме усиливаются процессы синтеза белка, что приводит к увеличению количества ферментов. Такие изменения повышают адаптационные возможности обмена веществ. Благодаря регулируемости активности ферментов можно осуществлять коррекцию отдельных звеньев обмена веществ в организме, что является актуальной проблемой медицины и спорта.
Большинство химических составных частей живого организма способно к множеству различных превращений. Фермент, ускоряя только одну какую-либо реакцию, препятствует всем побочным реакциям и тем самым определяет направление основного биохимического процесса.
Скорость реакции зависит от строения молекул реагирующих веществ (реагентов), их концентрации, температуры, давления, наличия катализатора и некоторых других факторов.
Реакция становится возможной только при столкновениях молекул. Чем больше молекул в единице объема, тем чаще они сталкиваются, т.е. скорость реакции повышается.
Не каждое столкновение реагирующих молекул приводит к химической реакции. Чтобы реакция началась, молекулы должны обладать определенным запасом энергии, достаточным для преодоления энергетического барьера, который создается межмолекулярными силами отталкивания и внутримолекулярными силами сцепления (прочностью химических связей).
Особенно большое количество энергии нужно для разрыва ковалентных связей,
преобладающих в молекулах органических веществ. Когда энергетический барьер преодолен и реакция началась, в ходе ее может выделиться значительно больше энергии, чем затрачено на начало процесса. Изменения энергии, происходящие в ходе химических реакций, можно изобразить графически. Количество энергии, необходимое молю реагирующего вещества для вступления в реакцию, называется энергией активации и рассчитывается в кДж/моль.
 |
Чем больше в веществе активных (возбужденных) молекул, способных преодолеть энергетический барьер, тем выше скорость его химических превращений. Запас энергии зависит от особенностей химического строения молекул и тех внешних воздействий, которым они подвергаются. В обычных условиях только незначительная часть молекул вещества находится в активном состоянии. Активация их происходит при нагревании вещества, передаче ему лучистой энергии (например, в фотохимических реакциях), столкновениях с другими, уже возбужденными молекулами или атомами.
С повышением температуры на каждые 10° скорость реакции возрастает в среднем в 2—3 раза. Скорость реакции можно увеличить, повышая давление (если реагенты являются газами): активные молекулы сближаются, и частота столкновений между ними увеличивается.
В живых организмах большие колебания температуры и давления невозможны. В них создаются условия, в которых для взаимодействия веществ требуется меньшая энергия активации. Это достигается снижением энергетического барьера реакции за счет уменьшения сил отталкивания между молекулами и ослабления химических связей.

Согласно современным представлениям, механизм взаимодействия ферментов с субстратами связан с образованием нестойких ферментсубстратных комплексов
В процессе образования фермент-субстратного комплекса в субстрате происходит перераспределение энергии, что приводит к разрыву или образованию химических связей. Так, например, энергия активации сахарозы при гидролитическом расщеплении без фермента составляет 134 кДж / моль»1 (25,6 ккал / моль»1), а в присутствии фермента (сахаразы) — только 39,3 кДж/моль»1 (8 ккал/ моль — 1).
Процесс взаимодействия фермента с субстратом протекает в несколько стадий, представленных на рис:
• взаимодействие субстрата с активным центром фермента и образование ферментсубстратного комплекса;
• преобразование первичного ферментсубстратного комплекса в другие ферментсубстратные комплексы, в ходе которых вещества переходят в активное состояние и далее распадаются на фермент и продукты реакции;
• отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду.
Сам фермент в ходе реакции не изменяется и может взаимодействовать с новыми молекулами субстрата.
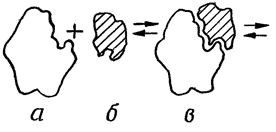 |  |
а- фермент б- субстрат в- фермент-субстрат- е- продукты реакции
Факторы, влияющие на действие ферментов
Скорость биохимических реакций, которая определяется по изменению концентрации реагирующих или образовавшихся веществ в единицу времени, зависит от активности ферментов и условий протекания реакции. Каждый фермент имеет свои оптимальные условия проявления активности. Оптимальными считаются условия, при которых ферментативная реакция протекает с максимальной скоростью. На скорость ферментативных реакций влияют: количество фермента; концентрация субстрата; активная реакция среды (рН); температура; присутствие активаторов и ингибиторов.
Концентрация фермента и субстрата. Скорость ферментативной реакции увеличивается с увеличением количества фермента при высокой концентрации субстрата. В организме в состоянии относительного покоя многие ферменты не проявляют максимальную активность из-за низкой концентрации их субстратов. При мышечной деятельности усиливается энергетический обмен и накапливаются субстраты многих реакций, что способствует повышению активности многих ферментов.
Активная реакция среды. Каждый фермент имеет узкий диапазон значений рН, при котором активность его максимальна. Большинство ферментов проявляют максимальную активность в организме при значениях рН, близких к 7,0, т. е. в нейтральной среде (рис. 39). Однако отдельные .ферменты проявляют высокую активность в сильно кислой среде, например пепсин (рН 2,0), сахараза (рН 4,5), или щелочной среде, например трипсин (рН 8,0), липаза (рН 9,0), аргиназа (рН 9,7).
Влияние рН среды на активность ферментов связано с изменением степени ионизации их белковой молекулы под воздействием протонов Н или гидроксилов (ОН»), что в первую очередь влияет на структуру активного центра фермента.
В организме человека в состоянии относительного покоя диапазон колебаний рН незначителен и ферменты «работают» в своих оптимальных режимах. При интенсивных физических нагрузках в мышцах накапливзетмолочная кислота, способная закислять среду и снижать активность многих ферментов.
Температура. При повышении температуры от 0 до 40 °С активность Ферментов, как правило, повышается (рис. 40). Температурный коэффициент Q10 = 2, что указывает на повышение скорости ферментативной реакции в два раза при изменении температуры на 10 °С. Дальнейшее повышение температуры до 45—55 °С приводит к резкому снижению активности ферментов вследствие тепловой денатурации белка. Все ферменты имеют свою оптимальную температуру, при которой активность их максимальная (для многих ферментов оптимальной является температура 37— 40 °С). Однако имеются и термостабильные ферменты, например миокиназа, активность которой сохраняется при нагревании до 100 °С. При понижении температуры активность ферментов снижается. Тем не менее необратимая денатурация их не происходит, так как в условиях оптимальных температур их активность восстанавливается (примером может служить зимняя спячка животных). Это свойство ферментов используется при замораживании продуктов, а также органов и генетического материала, используемых для трансплантации.
Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов. Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение.
В качестве активаторов могут выступать самые разнообразные вещества. Это прежде всего ионы двухвалентных металлов, таких как Mg 2+ , Zn 2+ , Mn 2+ , Co 2+ , Cu 2+ , Fe 2+ , Ca 2+ . Они вызывают обратимое изменение структуры активного центра. Так, карбоангидраза активируется ионами Zn 2+ , креатинкиназа — ионами Мg 2+ ; АТФ-аза миозина мышц активируется ионами Са 2+ , для каталитической активности ферментов дыхательной цепи необходимы ионы Си 2+ и Fe 2+ .
Активация некоторых ферментов может осуществляться путем модификации их молекулы и не затрагивать активный центр фермента. Так, HCI активирует пепсиноген желудочного сока, переводя его из неактивной формы в активную (пепсин). Панкреатическая липаза активируется желчными кислотами.
В качестве ингибиторов часто выступают вещества, близкие по строению к субстратам, которые связываются с активным центром фермента. Ингибирование бывает обратимое и необратимое. При обратимом ингибировании ингибитор легко отделяется от фермента и активность фермента восстанавливается. При необратимом ингибировании ингибитор прочно связывается с ферментом и закрывает доступ субстрата к активному центру.
Процесс ингибирования широко используется для коррекции обменных процессов в медицине и других областях деятельности человека. Лечебный эффект ряда лекарственных препаратов обусловлен их ингибиторным действием на отдельные ферменты. Среди ингибиторов, которые обратимо ингибируют ферменты, выделяют конкурентные и неконкурентные ингибиторы.
Конкурентные ингибиторы имеют структуру, подобную субстрату, и конкурируют с ним за место связывания в активном центре фермента. В случае конкурентного торможения ингибитор присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. При высокой концентрации субстрата такие ингибиторы неэффективны.
Неконкурентные ингибиторы реагируют не с активным центром фермента, а с другой частью его молекулы. Это вызывает изменение структуры активного центра, что нарушает процесс катализа. Действие таких ингибиторов можно устранить только химическим изменением структуры их молекулы. К неконкурентным ингибиторам относятся ионы тяжелых металлов и их органические соединения (ртуть, свинец, мышьяк и многие яды), способные блокировать SH-группы в ферменте и нарушать или полностью подавлять обменные процессы в организме.
источник
Витамин РР (никотиновая кислота, никотинамид, ниацин) получил также название антипеллагрического витамина (от итал. preventive pellagra – предотвращающий пеллагру), поскольку его отсутствие является причиной заболевания, называемого пеллагрой.
Никотиновая кислота известна давно, однако только в 1937 г. она была выделена К. Эльвегеймом из экстракта печени и было показано, что введение никотиновой кислоты (или ее амида – никотинамида) либо препаратов печени предохраняет от развития или излечивает от пеллагры. В 1904 г. А. Гарден и У. Юнг установили, что для превращения глюкозы в этанол в бесклеточном экстракте дрожжей необходимо присутствие легкодиализируемого кофактора, названного козимазой. Химический состав аналогичного кофактора из эритроцитов млекопитающих был расшифрован в 1934 г. О. Варбугом и У. Кристианом; он оказался производным амида никотиновой кислоты.
Никотиновая кислота представляет собой соединение пиридинового ряда, содержащее карбоксильную группу (никотинамид отличается наличием амидной группы).
Витамин РР малорастворим в воде (примерно 1%), но хорошо растворим в водных растворах щелочей. Никотиновая кислота кристаллизуется в виде белых игл.
Наиболее характерными признаками авитаминоза РР, т.е. пеллагры (от итал. pelle agra – шершавая кожа), являются поражения кожи (дерматиты), пищеварительного тракта (диарея) и нарушения нервной деятельности (деменция).
Дерматиты чаще всего симметричны и поражают те участки кожи, которые подвержены влиянию прямых солнечных лучей: тыльную поверхность кистей рук, шею, лицо; кожа становится красной, затем коричневой и шершавой. Поражения кишечника выражаются в развитии анорексии, тошнотой, болями в области живота, поносами. Диарея приводит к обезвоживанию организма. Слизистая оболочка толстой кишки сначала воспаляется, затем изъязвляется. Специфичными для пеллагры являются стоматиты, гингивиты, поражения языка со вздутием и трещинами. Поражения мозга проявляются головными болями, головокружением, повышенной раздражимостью, депрессией и другими симптомами, включая психозы, психоневрозы, галлюцинации и др. Симптомы пеллагры особенно резко выражены у больных с недостаточным белковым питанием. Установлено, что это объясняется недостатком триптофана, который является предшественником никотинамида, частично синтезируемого в тканях человека и животных, а также недостатком ряда других витаминов (пиридоксина; см. главу 12).
Биологическая роль. Витамин РР входит в состав НАД или НАДФ, являющихся коферментами большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ (формулы ко-ферментов приведены в главе 9).
Показано, что ряд дегидрогеназ использует только НАД и НАДФ (соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа), другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них (например, глутаматдегидрогеназа; см. главу 12). В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами (молекулярные механизмы участия пиридиновых нуклеотидов в этом процессе подробно рассматриваются в главе 9).
Распространение в природе и суточная потребность. Никотиновая кислота также относится к витаминам, широко распространенным в растительных и животных организмах. Для человека основными источниками никотиновой кислоты и ее амида являются рис, хлеб, картофель, мясо, печень, почки, морковь и другие продукты. Суточная потребность для взрослого человека составляет 18 мг.
источник
органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента — апоферментом, К. образуют каталитически активный комплекс — холофермент. Прочно связанные с белками К. называются простетическими группами. Многие К. легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. К. могут участвовать в активировании молекул субстратов, образуя с ними реакционно-способные соединения, которые затем подвергаются ферментативному превращению. Некоторые метаболиты, выступающие в ферментативных реакциях как обычные субстраты, в определенных условиях могут выполнять роль К. Многие К. являются производными витаминов (Витамины), поэтому нарушение обмена веществ при витаминной недостаточности (Витаминная недостаточность) опосредовано через понижение активности определенных ферментов.
Коферменты, как правило, термостабильны, разнообразны по химическому строению и механизму действия. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также К., содержащие остатки фосфорной кислоты. Адениловые нуклеотиды наряду с их ключевой ролью в обмене энергии (см. Макроэргические соединения, Обмен веществ и энергии) в качестве К. участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот. В группу адениловых нуклеотидов входят аденозинфосфорные кислоты — нуклеотиды, содержащие аденин, рибозу и остатки фосфорной кислоты (АДФ и АМФ). В подобных реакциях могут участвовать в качестве К. также производные инозин-5′-фосфорной и гуанозин-5′-фосфорной кислот. Гуаниловые рибонуклеотиды (гуанозин-5′-моно-, ди- и трифосфорные кислоты) выполняют роль К. в реакциях переноса сукцинильной группы, при биосинтезе рибонуклеопротеинов в микросомах, биосинтезе адениловой кислоты из инозиновой кислоты и др. Цитидиловые рибонуклеотиды (цитидил-5′-моно-, ди- и трифосфорные кислоты) играют роль К. при биосинтезе фосфолипидов, участвуя в переносе остатков, образующих полярные «головки» молекул фосфолипидов (0-фосфоэтанолхолина, 0-фосфоэтаноламина и др.). Уридиловые рибонуклеотиды (уридин-5′-моно, ди- и трифосфорные кислоты) участвуют в качестве К. в процессах трансгликозилирования (переноса остатков простых сахаров и их производных) при биосинтезе ди- и полисахаридов, гликозаминогликанов и реакциях взаимопревращения сахаров.
К важнейшим К. нуклеотидной природы относятся никотинамидные К. никотинамидадениндинуклеотид (НАД, NAD + ; синоним: дифосфопиридиннуклеотид, ДПН; устаревшее кофермент I, Kol, козимаза, кодегидр (оген)аза I] и его фосфорилированное производное никотинамидадениндинуклеотидфосфат [НАДФ, NADP + ; синоним: трифосфопиридиннуклеотид, ТПН; устаревшее кофермент II, KoII, фосфокозимаза, фосфокодегидр(оген)аза]. Никотинамидные К. входят в состав ряда дегидрогеназ — катализаторов ключевых окислительно-восстановительных реакций энергетического и пластического обмена. Молекула НАД представляет собой динуклеотид, построенный из аденинрибонуклеотида и никотинамидрибонуклеотида (последний отвечает за проявление каталитической активности НАД), связанных фосфоангидридным мостиком, а НАДФ имеет третий остаток фосфорной кислоты в положении 2′ рибозы аденилового нуклеотида. Способность НАД и НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обеспечивает выполнение этими К. важной биологической функции в процессе клеточного дыхания (см. Дыхание тканевое). Окислительно-восстановительные реакции, протекающие с участием никотинамидных К., могут быть изображены в виде общего уравнения; АН2 + НАД(Ф) + = А + НАД(Ф)Н + Н + , где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н + . Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.
Определение этих К. производят обычно спектрофотометрически (по характерному поглощению окисленных форм при 260 нм восстановленных форм или при 340 нм), флюориметрически (длина волны возбуждения 340 нм, флюоресценции 480 нм) или потенциометрически.
Флавиновые нуклеотиды, или флавиновые К. (флавинмононуклеотид, ФМН, 5-фосфорный эфир рибофлавина.; флавинадениндинуклеотид, ФАД, рибофлавин-5′-аденозиндифосфат), являются К. так называемых флавопротеинов — ферментов, широко распространенных в живых клетках, принимающих участие в обмене основных классов органических соединений и играющих важную роль в процессе биологического окисления (см. Дыхание тканевое). К флавиновым К. относится рибофлавин (витамин В2), недостаточность которого приводит к нарушению нормального функционирования флавинзависимых ферментов. В окисленном состоянии флавиновые К. имеют интенсивный желтый цвет, в восстановленном состоянии они бесцветны. Как правило, ФМН и ФАД прочно связаны с соответствующими белками-апоферментами. Флавопротеины (ферменты, коферментами которых являются производные флавинов) принадлежат к дыхательным ферментам класса оксидоредуктаз. Механизм окислительно-восстановительных реакций, катализируемых ими, обусловлен последовательным окислением и восстановлением флавиновых коферментов. Ряд ферментов (например, монооксигеназы) наряду с флавиновыми используют и никотинамидные К. Определение флавиновых К. проводят спектрофотометрически или флюориметрически в характерных для них областях поглощения при определенных длинах волн.
Кофермент А (КоА, восстановленная форма KoASH; синоним коэнзим А) — соединение аденозин-3′,5′-фосфорной кислоты и β-меркаптоэтиламида пантотеновой кислоты, образующее с остатками органических кислот (R) тиоэфиры типа R—СО—SKoA. Играет роль К. в переносе и активировании кислотных остатков в реакциях ацилирования, конденсации, оксидоредукции или гидратации органических кислот. КоА участвует в клеточном дыхании, биосинтезе и окислении жирных кислот (Жирные кислоты), синтезе стероидов. Для нормального синтеза КоА необходимо адекватное поступление в организм пантотеновой кислоты, входящей в состав КоА.
Кофермент В12 (КоВ12, витамин В12) — α-(5,6-диметилбензимидазолил)-кобаламинцианид является коферментом ферментов, участвующих в переносе одноуглеродных фрагментах, обмене метионина и других соединений. Недостаток в рационе витамина В12, вызывающий в организме дефицит кофермента В12, клинически проявляется мегалобластной гиперхромной анемией, ее так называемой нутритивной (алиментарной) В12-дефицитной формой. Эндогенная недостаточность витамина В12 вследствие нарушения всасывания этого витамина в кишечнике также приводит к дефициту кофермента В12, клинически проявляющемуся одной из форм мегалобластной гиперхромной анемии — пернициозной (В12-дефицитной) анемией, или анемией Аддисона — Бирмера.
Пиридоксальфосфат и его производные являются простетическими группами ряда ферментов, участвующих в обмене аминокислот (Аминокислоты) (реакциях трансаминирования, декарбоксилирования и др.), а также фермента гликогенфосфорилазы. При недостаточном поступлении в организм пиридоксальфосфата — производного витамина В6 — нарушаются функции пиридоксальзависимых ферментов.
Дифосфотиамин является коферментом кетолаз и транскетолаз — ферментов, участвующих в декарбоксилировании α-кетокислот и расщеплении углеродной цепи фосфорилированных сахаров, и представляет собой производное витамина В1 (тиамина).
Менее распространены К. пептидной природы, важнейшим представителем которых является глутатион (CSH, ГSH, окисленный глутатион — CSSC или ГSSГ) — υ-L-глутамил-L-цистеинил-L-глицин, который принимает активное участие во многих окислительно-восстановительных реакциях и обеспечивает функционирование ряда SH-зависимых ферментов. Наиболее важной функциональной группой восстановленной формы глутатиона является сульфгидрильная (SH-) группа, которая легко подвергается ферментативному или неферментативному окислению с образованием дисульфидной (окисленной) формы глутатиона, состоящей из двух молекул восстановленного глутатиона (Г—S— S—Г). Таким образом глутатион функционирует как переносчик водорода. Глутатион принимает прямое участие в некоторых реакциях цис-транс-изомеризации, является коферментом системы глиоксилазы, формальдегид-дегидрогеназы, глутатионпероксидазы. С генетически обусловленным нарушением обмена глутатиона связан ряд наследственных болезней, в т.ч. наследственные гемолитические Анемии. Определение глутатиона производят колориметрически и ферментативными методами с применением глутатионпероксидазы и глутатионредуктазы.
Липоевая (тиоктовая) кислота — насыщенная серосодержащая жирная кислота — входит в качестве одного из К. в состав мультиферментных комплексов, осуществляющих декарбоксилирование α-кетокислот (пировиноградной, α-кетоглутаровой кислот). Выполняет роль промежуточного акцептора водорода и кислотных остатков за счет своей способности к обратимому восстановлению (переход S—S→SH).
Витамины К — жирорастворимые соединения, производные нафтохинона — играют роль К. в реакциях системы свертывания крови. Их водорастворимый аналог — викасол — применяют в медицине в качестве лекарственного средства.
Биотин (витамин Н) — водорастворимый витамин — выступает в качестве К. (простетической группы) в составе ряда ферментов, катализирующих реакции карбоксилирования — декарбоксилирования некоторых органических кислот, например пируваткарбоксилазы и ацетил-КоА-карбоксилазы — ферментов начальных этапов глюконеогенеза и синтеза липидов соответственно. В активном центре молекулы карбоксилаз биотин прочно связан амидной связью с ε-аминогруппой остатка лизина фермента.
Библиогр.: Диксон М. и Уэбб Э. Ферменты, пер. с англ., т. 1—3, М., 1982; Коферменты, под ред. А.А. Яковлева, М., 1973.
источник
