Коферменты представляют собой органические соединения небелковой природы, которые необходимы для функционирования многих ферментов. Большинство из них являются производными витаминов.
Причиной нарушения метаболизма и снижения синтеза полезных веществ в организме часто является снижение активности некоторых видов ферментов. Поэтому то коэнзимы столь нам необходимы.
В узком смысле, кофермент – это коэнзим Q10, производная фолиевой кислоты и некоторых других витаминов. Важное значение для организма человека имеют те коферменты, которые продуцируются витаминами группы B.
Кофермент нужен для того, чтобы повысить производительность клеточной энергии, которая нужна для поддержания жизнедеятельности. Любой процесс, который протекает в организме человека, требует колоссального энергетического ресурса, будь то умственная деятельность, работа сердечно-сосудистой или пищеварительной системы, физическая активность при нагрузке на опорно-двигательный аппарат. Благодаря реакции, в которую коферменты вступают с ферментами, продуцируется необходимая энергия.
Коферменты представляют собой небелковые соединения, которые способствуют активации потенциала ферментов. Они выполняют 2 основные функции:
- Участвуют в каталитических процессах. Кофермент сам по себе не вызывает в организме необходимых молекулярных превращений, в состав ферментов он входит вместе с апоферментом, и только при их взаимодействии происходят каталитические процессы связывания субстрата.
- Транспортировочная функция. Кофермент соединяется с субстратом, в результате чего образуется прочный транспортировочный канал, по которому свободно перемещаются молекулы до центра другого фермента.
Все коферменты объединяет одно важное свойство – они являются термически устойчивыми соединениями, но свойственные им химические реакции довольно сильно разнятся.
По способам взаимодействия с апоферментом коферменты делятся на:
- Растворимые – во время реакции соединяется с молекулой фермента, после чего изменяется по химическому составу и высвобождается заново.
- Простетические – прочно связаны с апоферментом, в процессе реакции находится в активном центре фермента. Их регенерация происходит при взаимодействии с другим коферментом или субстратом.
По химической структуре коферменты делятся на три группы:
- алифатические (глутатион, липоевая кислота и др.)
- гетероциклические (пиридоксальфосфат, тетрагидрофолиевая кислота, нуклеозидфосфаты и их производные (КоА, ФМН, ФАД, НАД и др.), металлопорфириновые гемы и др.
- ароматические (убихиноны).
По функциональному признаку выделяют две группы коферментов:
- окислительно-восстановительные,
- коферменты переноса групп.
При интенсивных физических нагрузках расходуется большое количество энергии, ее запас в организме истощается, а многие витамины и питательные вещества потребляются гораздо быстрее, чем вырабатываются. Спортсмены испытывают физическую слабость, нервное истощение, нехватку сил. Для того чтобы помочь избежать многих симптомов были разработаны специальные препараты с коферментами в составе. Их спектр действия очень широк, назначаются они не только спортсменам, но и людям с достаточно серьезными заболеваниями.
Кофермент, который образуется только из поступающего в организм тиамина. У спортсменов он служит средством профилактики перенапряжения миокарда, расстройств нервной системы. Препарат назначается при радикулитах, невритах, а также острой печеночной недостаточности. Вводится внутривенно, разовая доза не должна быть менее 100 мг.
Заменяет по действию функционал витамина B12, является анаболиком. Помогает спортсменам нарастить мышечную массу, увеличивает выносливость, способствует быстрому восстановлению после занятий. Выпускается в форме таблеток и растворов для внутривенного введения, суточная норма составляет 3 таблетки или 1000 мкг. Длительность курса – не более 20 дней.
По своему действию схож с витамином B12, но намного дольше держится в крови и гораздо оперативнее преобразуется в коферментную формулу благодаря прочному соединению с плазменными белками.
Для препарата характерны все свойства витамина B6. От него он отличается быстрым терапевтическим эффектом, назначается к приему даже при нарушении фосфорилирования пиридоксина. Принимается три раза в день, суточная доза составляет не более 0,06 гр, а курс – не дольше месяца.
Активизирует метаболические процессы центральной нервной системы, повышает проходимость глюкозы, препятствует избыточному образованию молочной кислоты, повышает защитные свойства тканей, в том числе устойчивость к гипоксии, которая возникает во время интенсивных спортивных тренировок. Принимают препарат три раза в день по 0,1 гр. после завтрака в течение месяца
Является гомологом пантотеновой кислоты, ускоряет обменные процессы, снижает проявление болевых реакций, повышает устойчивость клеток к гипоксии. Действие препарата направлено на активацию работы головного мозга, повышение выносливости, показан к применению при черепно-мозговых травмах различного типа. Таблетки принимаются в течение месяца по 0,5 гр не чаще трех раз в день.
Выпускается в форме препарата для инъекций, действие которых направлено на активацию жирового обмена, ускорение регенерации клеток. Оказывает анаболическое, антигипоксическое и антитиреоидное действие. Является синтетическим заменителем витамина B6. Эффективен в виде внутривенной капельницы.
Образуется в организме из рибофлавина, активно участвует в углеводном, липидном и аминокислотном обмене. Выпускается в виде раствора для внутримышечных инъекций, так как его усвоение в желудке неэффективно при нарушении всасывания рибофлавина.
Нормализует углеводный обмен. Повышает скорость окисления углеводов и жирных кислот, что способствует повышению энергетического запаса.
источник
В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов.
Ферменты подразделяют на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром. Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка. Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике.
Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями.
Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода:
Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и р-меркаптоэтанол, содержащий SH-rpynny. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих пере-нос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жир-ных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот.
Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В, (тиа-мин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов.
Пиридоксалевые и кобаламидные коферменты являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков.
Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент.
Убихиноновые коферменты (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования.
Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТф, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов.
Свойства ферментов
Для ферментов характерны высокая каталитическая активность, специфичность действия и регулируемость их активности.
Благодаря высокой каталитической активности ферментов скорость некоторых химических реакций увеличивается в миллионы раз. Примером может служить обратимая реакция синтеза и распада угольной кислоты, которую катализирует фермент карбоангидраза: СО2 + Н2О = Н2СО3. Одна молекула карбоангидразы эритроцитов способна связывать до 105 молекул СО2 в секунду, при этом скорость реакции в присутствии фермента увеличивается в 107 раз. Реакция синтеза Н2СО3 постоянно протекает в тканях организма при связывании метаболического СО2, а реакция распада Н2СО3 интенсивно протекает в капиллярах легких, где происходит выведение СО2 из организма при выдохе.
Очень высокую активность проявляет каталаза, которая катализирует расщепление токсичного для организма вещества — перекиси водорода: 2Н2О2 -> 2Н2О + О2. При температуре 0° С одна молекула каталазы разлагает 40 000 молекул Н2О2 в секунду.
Специфичность действия ферментов состоит в том, что фермент может катализировать превращение определенного субстрата или действовать на один из типов химических связей в нем. Благодаря этому в клетке множество химических реакций протекает одновременно в строго определенном порядке. Различают ферменты с абсолютной, относительной и групповой специфичностью. Абсолютная специфичность фермента проявляется в том, что он катализирует превращение молекул только одного субстрата. Например, фермент аргиназа способен катализировать распад только аргинина на мочевину и орнитин, а ферменты сахараза, мальтаза, лактаза способны расщеплять только соответствующие дисахариды. Относительной специфичностью действия обладают ферменты, которые катализируют разрыв определенного типа химической связи в молекулах разных веществ. Для них строение молекулы субстрата не имеет решающего значения. Относительная специфичность характерна для пептидаз пищеварительного тракта (пепсина, трипсина, химотрипсина), которые расщепляют пептидную связь в различных белках и пептидах, а также фосфатаз, липаз, которые расщепляют эфирные связи в молекулах различных веществ. Ферменты действуют только на один из нескольких изомеров субстрата. Групповая специфичность характерна для ферментов, которые действуют на субстраты с одинаковым типом связи и подобным строением молекул. Так, например, холинэстеразы расщепляют эфирную вязь во многих субстратах, которые содержат остаток холина.
Регуляция процессов синтеза ферментов осуществляется на уровне генов и на уровне транскрипции (синтеза иРНК). Такие изменения наблюдаются при долговременном воздействии различных факторов среды, физических нагрузок и стероидных гормонов.
Процессы адаптации организма к физическим нагрузкам взаимосвязаны с совершенствованием различных механизмов регуляции активности ферментов. При срочной адаптации к физическим нагрузкам изменяется активность уже существующих ферментов. При долговременной адаптации в организме усиливаются процессы синтеза белка, что приводит к увеличению количества ферментов. Такие изменения повышают адаптационные возможности обмена веществ. Благодаря регулируемости активности ферментов можно осуществлять коррекцию отдельных звеньев обмена веществ в организме, что является актуальной проблемой медицины и спорта.
Большинство химических составных частей живого организма способно к множеству различных превращений. Фермент, ускоряя только одну какую-либо реакцию, препятствует всем побочным реакциям и тем самым определяет направление основного биохимического процесса.
Скорость реакции зависит от строения молекул реагирующих веществ (реагентов), их концентрации, температуры, давления, наличия катализатора и некоторых других факторов.
Реакция становится возможной только при столкновениях молекул. Чем больше молекул в единице объема, тем чаще они сталкиваются, т.е. скорость реакции повышается.
Не каждое столкновение реагирующих молекул приводит к химической реакции. Чтобы реакция началась, молекулы должны обладать определенным запасом энергии, достаточным для преодоления энергетического барьера, который создается межмолекулярными силами отталкивания и внутримолекулярными силами сцепления (прочностью химических связей).
Особенно большое количество энергии нужно для разрыва ковалентных связей,
преобладающих в молекулах органических веществ. Когда энергетический барьер преодолен и реакция началась, в ходе ее может выделиться значительно больше энергии, чем затрачено на начало процесса. Изменения энергии, происходящие в ходе химических реакций, можно изобразить графически. Количество энергии, необходимое молю реагирующего вещества для вступления в реакцию, называется энергией активации и рассчитывается в кДж/моль.
 |
Чем больше в веществе активных (возбужденных) молекул, способных преодолеть энергетический барьер, тем выше скорость его химических превращений. Запас энергии зависит от особенностей химического строения молекул и тех внешних воздействий, которым они подвергаются. В обычных условиях только незначительная часть молекул вещества находится в активном состоянии. Активация их происходит при нагревании вещества, передаче ему лучистой энергии (например, в фотохимических реакциях), столкновениях с другими, уже возбужденными молекулами или атомами.
С повышением температуры на каждые 10° скорость реакции возрастает в среднем в 2—3 раза. Скорость реакции можно увеличить, повышая давление (если реагенты являются газами): активные молекулы сближаются, и частота столкновений между ними увеличивается.
В живых организмах большие колебания температуры и давления невозможны. В них создаются условия, в которых для взаимодействия веществ требуется меньшая энергия активации. Это достигается снижением энергетического барьера реакции за счет уменьшения сил отталкивания между молекулами и ослабления химических связей.

Согласно современным представлениям, механизм взаимодействия ферментов с субстратами связан с образованием нестойких ферментсубстратных комплексов
В процессе образования фермент-субстратного комплекса в субстрате происходит перераспределение энергии, что приводит к разрыву или образованию химических связей. Так, например, энергия активации сахарозы при гидролитическом расщеплении без фермента составляет 134 кДж / моль»1 (25,6 ккал / моль»1), а в присутствии фермента (сахаразы) — только 39,3 кДж/моль»1 (8 ккал/ моль — 1).
Процесс взаимодействия фермента с субстратом протекает в несколько стадий, представленных на рис:
• взаимодействие субстрата с активным центром фермента и образование ферментсубстратного комплекса;
• преобразование первичного ферментсубстратного комплекса в другие ферментсубстратные комплексы, в ходе которых вещества переходят в активное состояние и далее распадаются на фермент и продукты реакции;
• отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду.
Сам фермент в ходе реакции не изменяется и может взаимодействовать с новыми молекулами субстрата.
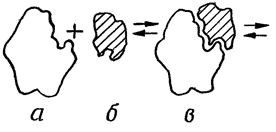 |  |
а- фермент б- субстрат в- фермент-субстрат- е- продукты реакции
Факторы, влияющие на действие ферментов
Скорость биохимических реакций, которая определяется по изменению концентрации реагирующих или образовавшихся веществ в единицу времени, зависит от активности ферментов и условий протекания реакции. Каждый фермент имеет свои оптимальные условия проявления активности. Оптимальными считаются условия, при которых ферментативная реакция протекает с максимальной скоростью. На скорость ферментативных реакций влияют: количество фермента; концентрация субстрата; активная реакция среды (рН); температура; присутствие активаторов и ингибиторов.
Концентрация фермента и субстрата. Скорость ферментативной реакции увеличивается с увеличением количества фермента при высокой концентрации субстрата. В организме в состоянии относительного покоя многие ферменты не проявляют максимальную активность из-за низкой концентрации их субстратов. При мышечной деятельности усиливается энергетический обмен и накапливаются субстраты многих реакций, что способствует повышению активности многих ферментов.
Активная реакция среды. Каждый фермент имеет узкий диапазон значений рН, при котором активность его максимальна. Большинство ферментов проявляют максимальную активность в организме при значениях рН, близких к 7,0, т. е. в нейтральной среде (рис. 39). Однако отдельные .ферменты проявляют высокую активность в сильно кислой среде, например пепсин (рН 2,0), сахараза (рН 4,5), или щелочной среде, например трипсин (рН 8,0), липаза (рН 9,0), аргиназа (рН 9,7).
Влияние рН среды на активность ферментов связано с изменением степени ионизации их белковой молекулы под воздействием протонов Н или гидроксилов (ОН»), что в первую очередь влияет на структуру активного центра фермента.
В организме человека в состоянии относительного покоя диапазон колебаний рН незначителен и ферменты «работают» в своих оптимальных режимах. При интенсивных физических нагрузках в мышцах накапливзетмолочная кислота, способная закислять среду и снижать активность многих ферментов.
Температура. При повышении температуры от 0 до 40 °С активность Ферментов, как правило, повышается (рис. 40). Температурный коэффициент Q10 = 2, что указывает на повышение скорости ферментативной реакции в два раза при изменении температуры на 10 °С. Дальнейшее повышение температуры до 45—55 °С приводит к резкому снижению активности ферментов вследствие тепловой денатурации белка. Все ферменты имеют свою оптимальную температуру, при которой активность их максимальная (для многих ферментов оптимальной является температура 37— 40 °С). Однако имеются и термостабильные ферменты, например миокиназа, активность которой сохраняется при нагревании до 100 °С. При понижении температуры активность ферментов снижается. Тем не менее необратимая денатурация их не происходит, так как в условиях оптимальных температур их активность восстанавливается (примером может служить зимняя спячка животных). Это свойство ферментов используется при замораживании продуктов, а также органов и генетического материала, используемых для трансплантации.
Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов. Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение.
В качестве активаторов могут выступать самые разнообразные вещества. Это прежде всего ионы двухвалентных металлов, таких как Mg 2+ , Zn 2+ , Mn 2+ , Co 2+ , Cu 2+ , Fe 2+ , Ca 2+ . Они вызывают обратимое изменение структуры активного центра. Так, карбоангидраза активируется ионами Zn 2+ , креатинкиназа — ионами Мg 2+ ; АТФ-аза миозина мышц активируется ионами Са 2+ , для каталитической активности ферментов дыхательной цепи необходимы ионы Си 2+ и Fe 2+ .
Активация некоторых ферментов может осуществляться путем модификации их молекулы и не затрагивать активный центр фермента. Так, HCI активирует пепсиноген желудочного сока, переводя его из неактивной формы в активную (пепсин). Панкреатическая липаза активируется желчными кислотами.
В качестве ингибиторов часто выступают вещества, близкие по строению к субстратам, которые связываются с активным центром фермента. Ингибирование бывает обратимое и необратимое. При обратимом ингибировании ингибитор легко отделяется от фермента и активность фермента восстанавливается. При необратимом ингибировании ингибитор прочно связывается с ферментом и закрывает доступ субстрата к активному центру.
Процесс ингибирования широко используется для коррекции обменных процессов в медицине и других областях деятельности человека. Лечебный эффект ряда лекарственных препаратов обусловлен их ингибиторным действием на отдельные ферменты. Среди ингибиторов, которые обратимо ингибируют ферменты, выделяют конкурентные и неконкурентные ингибиторы.
Конкурентные ингибиторы имеют структуру, подобную субстрату, и конкурируют с ним за место связывания в активном центре фермента. В случае конкурентного торможения ингибитор присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. При высокой концентрации субстрата такие ингибиторы неэффективны.
Неконкурентные ингибиторы реагируют не с активным центром фермента, а с другой частью его молекулы. Это вызывает изменение структуры активного центра, что нарушает процесс катализа. Действие таких ингибиторов можно устранить только химическим изменением структуры их молекулы. К неконкурентным ингибиторам относятся ионы тяжелых металлов и их органические соединения (ртуть, свинец, мышьяк и многие яды), способные блокировать SH-группы в ферменте и нарушать или полностью подавлять обменные процессы в организме.
источник
КОФЕРМЕНТЫ (син. коэнзимы) — низкомолекулярные органические соединения биологического происхождения, необходимые в качестве дополнительных специфических компонентов (кофакторов) для осуществления каталитического действия ряда ферментов. Многие К. представляют собой производные витаминов. Биол, эффект значительной группы витаминов (группы В) определяется их превращением в К. и ферменты в клетках организма. Были сделаны попытки (и небезуспешные) прямого использования некоторых К. с леч. целями. Трудности, которые при этом возникают, состоят в том, что не всегда производятся количественные определения содержания К. в крови и органах и еще реже определяется активность ферментов, синтезирующих или разрушающих исследуемые К., в норме и патологии. Обнаруженный при каком-либо заболевании недостаток того или иного К. обычно пытаются устранить, вводя в организм соответствующий витамин. Но если нарушены системы синтеза недостающего К., что нередко имеет место, то введение такого витамина теряет смысл: терапевтический эффект можно получить только введением недостающего кофермента. С леч. целями применяют кокарбоксилазу (см. Тиамин), ФАД, коферментные формы витамина В12 (см. Цианокобаламин) и некоторые другие К. В леч. целях К. вводят парентерально, но и при этом условии не всегда имеется уверенность, что они могут без расщепления проникнуть к месту своего действия (во внутриклеточную среду).
Обладая небольшим мол. весом, К., в отличие от биокатализаторов белковой природы (ферментов), характеризуются термостабильностью и доступностью диализу. Дыхательные хромогены растений (полифенолы), глутаминовую к-ту, орнитин, бисфосфаты (дифосфаты) глюкозы и глицериновой к-ты и другие метаболиты, действующие при определенных обстоятельствах как кофакторы ферментативных процессов переноса, нередко обозначают как К. соответствующих процессов. Правильнее применять термин «кофермент» только к соединениям, биол, функция которых сводится целиком или преимущественно к их специфическому участию в действии ферментов (см.).
Термин «кофермент» был предложен Г. Бертраном в 1897 г. для обозначения функции солей марганца, которые он считал специфическим кофактором фенол азы (лакказы); однако теперь неорганические компоненты ферментных систем не принято относить к числу К. Существование истинного (органического) К. впервые установили англ. биохимики Харден (A. Harden) и Янг (W. Young) в 1904 г., показавшие, что из ферментных экстрактов дрожжевых клеток при диализе удаляется термостабильное органическое вещество, необходимое для действия ферментного комплекса, катализирующего спиртовое брожение (см.). Этот вспомогательный катализатор брожения Харден и Янг назвали козимазой; его строение было установлено в 1936 г. в лабораториях X. Эйлер- Xeльпина и О. Варбурга почти одновременно.
Механизм действия К. неодинаков. Во многих случаях они действуют в качестве промежуточных акцепторов (переносчиков) определенных хим. группировок (фосфатных, ацильных, аминных и др.), атомов водорода или электронов. В других случаях К. участвуют в активировании молекул субстратов ферментативных реакций, образуя с этими молекулами реакционно-способные промежуточные соединения. В виде таких соединений субстраты подвергаются определенным ферментативным превращениям; таковы функции глутатиона (см.) как кофермента глиоксалазы и дегидрогеназы формальдегида, КоА — при ряде превращении жирных кислот (см.) и других органических к-т и т. д.
Типичные К. образуют непрочные сильно диссоциированные соединения со специфическими белками (апоферментами) растворимых ферментов, от которых они легко могут быть отделены путем диализа (см.) или гель-фильтрация (см.). При многих реакциях переноса групп, протекающих при сопряженном действии двух ферментных белков, происходит поочередное обратимое присоединение к молекулам этих белков частиц К. в двух формах — акцепторной и донорной (напр., окисленной и восстановленной, фосфорилированной и нефосфорилированной). В приведенной ниже схеме показан (в несколько упрощенной форме) механизм обратимого переноса водорода между молекулой донора водорода (АН2) и молекулой акцептора (Б) при действии двух дегидрогеназ (Фа и Фб) и кофермента (Ко):
В полном цикле окислительно-восстановительного процесса (реакции 1—6) кофермент кодегидрогеназа не изменяется и не входит в баланс продуктов реакции, т. е. служит катализатором. Если же рассматриваются последовательные фазы цикла, протекающие каждая с участием одного фермента (реакции 1—3 и 4—6), то Ко и КоН2 выступают наравне с молекулами АН2, А, Б, БН2 в качестве второго субстрата. В этом же смысле относительным является различие между субстратами и диссоциирующими К., участвующими в сопряженных реакциях переноса фосфатных, ацильных, гликозильных и других групп.
У многих двухкомпонентных ферментов, построенных по типу протеидов, апофермент образует с небелковым термостабильным компонентом прочное, труднодиссоциирующее соединение. Небелковые компоненты ферментов-протеидов, обычно называемые простетическими группами (напр., флавиновые нуклеотиды, пиридоксальфосфат, металлопорфирины), взаимодействуют с субстратом, оставаясь на всем протяжении ферментативной реакции в составе нерасщепленной молекулы одного протеида. Термин «кофермент» обычно распространяют и на химически взаимодействующие с молекулами субстратов, прочно связанные органические простетические группы ферментов, которые трудно отграничить от легко диссоциирующих К., т. к. между обоими типами кофакторов существуют постепенные переходы.
Точно также нельзя провести резкой грани между К. и нек-рыми промежуточными продуктами обмена веществ (метаболитами), которые в ферментативных процессах выступают то как обычные субстраты, подвергающиеся в данном процессе в основном необратимому изменению, то как необходимые вспомогательные катализаторы при сопряженных ферментативных превращениях, из которых эти метаболиты выходят неизмененными. Метаболиты такого рода могут служить промежуточными акцепторами тех или иных групп в процессах ферментативного переноса, протекающих аналогично процессу, схематично изображенному выше (напр., роль полифенолов как переносчиков водорода в дыхании растительных клеток, роль глутаминовой к-ты в переносе аминных групп путем реакций трансаминирования и т. п.), или в более сложных циклических превращениях с участием нескольких ферментов (примером может служить функция орнитина в цикле образования мочевины). Несколько иной характер носит коферментоподобное действие 1,6-бисфосфоглюкозы, к-рая служит необходимым кофактором и в то же время промежуточной ступенью в процессе межмолекулярного переноса фосфатных остатков при взаимопревращении 1-фосфоглюкозы и 6-фосфоглюкозы под действием фосфоглюкомутазы, когда молекула кофактора переходит в молекулу конечного продукта, отдавая один фосфатный остаток исходному продукту, из к-рого при этом образуется новая молекула кофактора. Точно такую же функцию выполняет 2,3-бисфосфоглицериновая к-та при катализируемом другой фосфомутазой взаимопревращении 2-фосфоглицериновой и 3-фосфоглицериновой к-т.
К. весьма разнообразны по хим. строению. Однако чаще всего среди них встречаются соединения двух типов: а) нуклеотиды и некоторые другие органические производные фосфорной к-ты; б) пептиды и их производные (напр., фолиевая к-та, КоА, глутатион). У животных и у многих микроорганизмов для построения молекул ряда К. необходимы соединения, которые этими организмами не синтезируются и должны доставляться с пищей, т. е. витамины (см.). Водорастворимые витамины группы В в большинстве своем входят в состав К., строение и функции которых известны (это относится к тиамину, рибофлавину, пиридоксалю, никотинамиду, пантотеновой к-те), или же могут сами действовать как активные молекулы К. (витамин В12, фолиевая к-та). То же, вероятно, относится и к другим водо- и жирорастворимым витаминам, роль которых в процессах биол, катализа еще полностью не выяснена.
Ниже перечислены важнейшие К. с указанием типа их строения и основных видов ферментативных превращений, в которых они участвуют. В статьях об отдельных К. приведены более детальные сведения об их структуре и механизме действия.
Коферменты нуклеотидной природы. Адениловые рибонуклеотиды (аденозин-5′-моно-, ди- и трифосфорные к-ты) участвуют в многочисленных реакциях активирования и переноса орто- и пирофосфатных остатков, остатков аминокислот (аминоацилов), угольной и серной к-т, а также в ряде других ферментативных превращений. Аналогичные функции в определенных случаях выполняют производные инозин-5′-фосфорной и гуанозин-5′-фосфорной к-т.
Гуаниловые рибоиуклеотиды (гуанозин-5′-моно-, ди- и трифосфорные к-ты) играют роль К. при реакциях переноса остатка янтарной к-ты (сукцинила), биосинтезе рибонуклеопротеидов в микросомах, биосинтезе адениловой к-ты из инозиновой и, возможно, при переносе остатков маннозы.
Цитидиловые рибонуклеотиды (цитидин-5′-фосфорные к-ты) при биосинтезе фосфатидов играют роль К. переноса остатков О-фосфоэтанол холина, О-фосфоэтаноламина и т. д.
Уридиловые рибонуклеотиды (уридин-5′-фосфорные к-ты) выполняют функции К. в процессах трансгликозилирования, т. е. переноса остатков моноз (глюкозы, галактозы и др.) и их производных (остатков гексозаминов, глюкуроновой к-ты и т. п.) при биосинтезе ди- и полисахаридов, глюкуронозидов, гексозаминидов (мукополисахаридов), а также при активировании остатков сахаров и их производных в некоторых других ферментативных процессах (напр., взаимопревращении глюкозы и галактозы и др.).
Никотинамидадениндинуклеотид (НАД) участвует в важнейших для клеточного обмена реакциях переноса водорода в качестве специфического К. многочисленных дегидрогеназ (см.).
Никотинамидадениндинуклеотидфосфат (НАДФ) участвует в важнейших для клеточного обмена реакциях переноса водорода в качестве специфического К. некоторых дегидрогеназ.
Флавинмононуклеотид (ФМН) участвует в биол, переносе водорода как К. (простетическая группа) некоторых флавиновых («желтых») окислительных ферментов.
Флавинадениндинуклеотид (ФАД) участвует в биол, переносе водорода как К. (простетическая группа) большинства флавиновых («желтых») окислительных ферментов.
Кофермент А (КоА, восстановленная форма — KoA-SH, кофермент ацилирования; соединение аденозин-З’ ,5′-бисфосфорной к-ты с пантотенил-аминоэтантиолом или пантетеином) образует с остатками уксусной и других органических к-т тиоэфиры типа R-СО—S-КоА, где R — остаток органической к-ты, и играет роль К. в переносе и активировании кислотных остатков как при реакциях ацилирования (синтез ацетилхолина, гиппуровой к-ты, парных желчных к-т и т. п.), так и при многих других ферментативных превращениях кислотных остатков (реакции конденсации, оксидоредукции или обратимой гидратации ненасыщенных к-т). При участии КоА протекает ряд промежуточных реакций клеточного дыхания, биосинтеза и окисления жирных к-т, синтеза стероидов, терпенов, каучука и т. п.
Кофермент B12 [KoB12; син. кобаламин, ДБК-кофермент, альфа-(5,6-диметилбензимидазолил)-кобамидцианид]. Возможно, что разнообразные биол, функции витамина В12, хим. механизм которых еще не ясен, напр, в процессе кроветворения, при биосинтезе метильных групп, превращениях сульфгидрильных групп (SH-групп) и т. д., обусловлены его ролью как К. в процессе биосинтеза белков-ферментов.
Другие коферменты, содержащие фосфатные остатки. Дифосфотиамин служит К. при декарбоксилировании (простом и окислительном) пировиноградной, альфа-кетоглутаровой и других альфа-кетокислот, а также при реакциях расщепления углеродной цепи фосфорилированных кетосахаров под действием особой группы ферментов (кетолазы, транскетолазы, фосфокетолазы).
Пиридоксальфосфат конденсируется с аминокислотами (и аминами) в активные промежуточные соединения типа оснований Шиффа (см. Шиффа основания); является К. (простетической группой) ферментов, катализирующих реакции трансаминирования и декарбоксилирования, а также многих других ферментов, которые осуществляют разнообразные превращения аминокислот (реакции расщепления, замещения, конденсации), играющие важную роль в клеточном обмене.
Коферменты пептидной природы. Кофермент формилирования. Восстановленная фолиевая к-та и ее производные, содержащие три или семь остатков глутаминовой к-ты, соединенных гамма-пептидными связями, играют роль К. в промежуточном обмене так наз. одноуглеродных, или «C1», остатков (формила, оксиметила и метила), участвуя как в реакциях переноса этих остатков, так и в их окислительно-восстановительных взаимопревращениях. Формильные и оксиметильные производные Н4-фолиевой к-ты являются «активными формами» муравьиной к-ты и формальдегида в процессах биосинтеза и окисления метильных групп, в обмене серина, глицина, гистидина, метионина, пуриновых оснований и т. д.
Глутатион. Восстановленный глутатион (Г-SH) действует по типу К. при превращении метилглиоксаля в молочную к-ту под влиянием глиоксалазы, при ферментативной дегидрогенизации формальдегида, в определенных стадиях биол, окисления тирозина и т. д. Кроме того, глутатион (см.) играет большую роль в защите различных тиоловых (сульфгидрильных) ферментов от инактивирования в результате окисления SH-групп или связывания их тяжелыми металлами и другими SH-ядами.
Прочие коферменты. Липоевая кислота является вторым К. дегидрогеназ пировиноградной и альфа-кетоглутаровой к-т (наряду с дифосфотиамином); при действии этих ферментов остаток липоевой к-ты, связанный амидной связью (СО — NH) со специфическими ферментными белками, выполняет функции промежуточного акцептора (переносчика) водорода и ацильных остатков (ацетила, сукцинила). Другие предполагаемые функции этого К. недостаточно изучены.
Витамин E (токоферол), витамин К (филлохинон) и продукты их окислительно-восстановительиых превращений или близкородственные производные n-бензохинона (убихинон, кофермент Q) рассматриваются как К. (переносчики водорода), участвующие в определенных промежуточных реакциях дыхательной окислительной цепи и в сопряженном с ними дыхательном фосфорилировании (см.). Установлено, что филлохинон (витамин К) играет роль К. в биосинтезе остатков альфа-карбоксиглутаминовой к-ты, входящих в состав молекул белковых компонентов системы свертывания крови.
Биотин — водорастворимый витамин, выполняющий роль К. или простетической группы в составе ряда ферментов, катализирующих реакции карбоксилирования — декарбоксилирования некоторых органических к-т (пировиноградной, пропионовой и др.). Эти ферменты имеют строение биотинил-протеидов, в которых соответствующий биотину ацильный остаток (биотинил) присоединен амидной связью к N6-аминогруппе одного из остатков лизина молекулы белка.
Аскорбиновая кислота служит активатором ферментной системы окисления тирозина в животных тканях и некоторых других ферментных систем (гидроксилаз), при действии которых в ядро ароматических и гетероциклических соединений, в т. ч. пептидно-связанных остатков пролина при биосинтезе коллагена (см.) и родственных белков, вводятся гидроксильные группы. В этих системах аскорбиновая к-та играет роль второго субстрата — донора водорода, окисляемого молекулярным кислородом параллельно с циклическим субстратом, а не роль истинного К. (специфического биокатализатора).
Библиография: Болдуин Э. Основы динамической биохимии, пер. с англ., с. 55 и др., М., 1949; Витамины, под ред. М. И. Смирнова, М., 1974; Диксон М. и Уэбб Э. Ферменты, пер. с англ., М., 1966; Коферменты, под ред. В. А. Яковлева, М., 1973; Кочетов Г. А. Тиаминовые ферменты, М., 1978, библиогр.; Ферменты, под ред. А. Е. Браунштейна, с. 147, М., 1964, библиогр.
источник
Ферменты – вещества белковой природы, ускоряющие биохимические реакции в организме.
По строению различают простые и сложные ферменты. Простые ферменты состоят из аминокислот – белковой части. Сложные ферменты состоят из белковой и небелковой частей. Небелковая часть называется кофактором. Кофактор может быть представлен производными витаминов, нуклеотидами, металлами.
В процессе биохимической реакции фермент превращает вещество – субстрат. Субстрат связывается с активным центром фермента при помощи водородных, ионных, гидрофобных связей. Активный центр простого фермента представлен радикалами аминокислот. Активный центр сложного фермента представлен кофактором.
Ферменты с четвертичной структурой имеют аллостерический центр, к которому присоединяются низкомолекулярные вещества, регулирующие активность ферментов.
Витамины – сложные вещества, которые участвуют в биохимических реакциях.
Витамины поступают в организм с пищей, ряд витаминов образуется микрофлорой кишечника в организме. При отсутствии какого-либо витамина в организме развивается авитаминоз по этому витамину. При недостатке какого-либо витамина развивается гиповитаминоз. При избытке какого-либо витамина развивается гипервитаминоз.
Витамины делятся на водорастворимые и жирорастворимые.
Витамин В1 – химическое название: тиамин; биологическое название: антиневритный. Образует кофактор тиаминпирофосфат, который входит в состав ферментов, участвующих в реакциях окисления углеводов с целью получения энергии.
При гиповитаминозе наблюдаются слабость, поражение нервной системы: невриты, которые сопровождаются болями, нарушением чувствительности, раздражительность, в тяжелых случаях наблюдаются парезы, параличи, нарушения психики. Эти симптомы связаны с накоплением в нервной ткани пирувата. В окислении пирувата участвует тиаминпирофосфат. Поэтому при гиповитаминозе по тиамину снижается окисление пирувата, и он накапливается в тканях. При этом наиболее чувствительной к накоплению пирувата является нервная ткань, поэтому при гиповитаминозе по тиамину прежде всего развиваются симптомы со стороны нервной системы. Кроме того, нарушение окисления пирувата ведет к недостатку энергии. Снижение энергии в организме также прежде всего сказывается на состоянии нервной системы.
Источниками тиамина являются прежде всего – неочищенные зерна злаков, молодые проростки злаков, мясо, хлеб.
Химическое название – рибофлавин; биологическое название — витамин роста.
Образует кофакторы – флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД). ФМН и ФАД входят в состав ферментов, которые участвуют в реакциях окисления углеводов, жирных кислот для получения энергии.
При гиповитаминозе наблюдается недостаток энергии в организме, что сопровождается снижением роста, слабостью, поражением нервной системы, сердечно-сосудистой системы, нарушением питания, ломкостью волос, ногтей.
Источники – мясо, молоко, яйца, печень, бобовые
Химическое название – пантотеновая кислота.
Образует кофермент – коэнзим А, который входит в состав ферментов, участвующих в окислении углеводов, липидов с целью получения энергии. Также кофермент участвует в синтезе липидов. Поэтому при недостатке пантотеновой кислоты развиваются симптомы – слабость, нарушении функции нервной, эндокринной систем, желудочно-кишечного тракта, поражение кожи.
Источники – мясо, яйца, молоко, печень, микрофлора кишечника.
Химическое название – никотиновая кислота, никотинамид, ниацин; биологическое название – антипеллагрический.
Образует коферменты – никотинамиддинуклеотид (НАД), никотинамиддинуклеотидфосфат (НАДФ). Эти коферменты входят в состав ферментов, которые участвуют в реакциях окисления углеводов, липидов с целью получения энергии. Поэтому при гиповитаминозе по никотинамиду развивается недостаток энергии, поражение органов и систем, поражение кожи – пеллагра (шелушение, зуд, покраснение).
Источники – мясо, молоко, яйца, печень. В организме никотинамид образуется из незаменимой аминокислоты трипотофана, которая поступает с продуктами животного происхождения.
Химическое название – пиридоксин, пиридоксаль, пиридоксамин; биологическое название – антидерматитный витамин.
Образует коферменты – пиридоксальфосфат и пиридоксаминфосфат. Эти коферменты входят в состав ферментов, которые участвуют в реакциях обмена аминокислот, синтезе гема, биогенных аминов, которые регулируют процессы обмена в нервной ткани. При гиповитаминозе по витамину наблюдаются анемия из-за снижения синтеза гема, снижается количество биогенных аминов, что вызывает нарушения со стороны нервной системы, нарушается синтез аминокислот, белков, углеводов. Кроме того, гиповитаминоз проявляется поражениями кожи в виде дерматитов.
Источники – мясо, молоко, яйца, печень, микрофлора кишечника.
Химическое название – фолиевая кислота.
Образует кофермент тетрагидрофолиевая кислота, который входит в состав ферментов, участвующих в синтезе азотистых оснований, аминокислот, а значит в синтезе нуклеиновых кислот, белков, что важно для размножения, развития, созревания клеток.
При гиповитаминозе наблюдается макроцитарная анемия, т.к. нарушается созревание эритроцитов, в результате в крови обнаруживаются незрелые эритроциты – макроциты, у которых снижена функция переноса кислорода.
Источники – растительная пища, микрофлора кишечника.
Химическое название – цианокобаламин, биологическое название – антианемический.
Образует коферменты – метилкобаламин, кобаламин. Эти коферменты входят в состав ферментов, которые участвуют в обмене азотистых оснований, регенерации метионина, синтезе сложных липидов, холина, креатина. При гиповитаминозе развивается макроцитарная анемия из-за нарушения созревания эритроцитов; нарушается синтез липопротеинов и функций мембран из-за недостатка холина, наблюдается снижение образования энергии с участием креатинфосфата.
Источники – мясо, молоко, яйца, печень, микрофлора кишечника
Химическое название – аскорбиновая кислота, биологическое название – антицинготный
Участвует в реакциях синтеза коллагена, обмена аминокислот, окислительно-восстановительных реакциях с целью получения энергии, обеспечивает всасывание железа в тонком кишечнике. При гиповитаминозе нарушается синтез коллагена, что сказывается на состоянии соединительной ткани, она становится слабой, хрупкой, ломкой. Например, становятся ломкими сосуды, в результате могут быть подкожные гематомы, частые носовые кровотечения. Кроме того, при гиповитаминозе развивается железодефицитная анемия, т.к. снижается всасывание железа в тонком кишечнике.
Источники – преимущественно цитрусовые, смородина, шиповник
Химическое название – биотин, биологическое название – антисеборейный.
Биотин участвует в реакциях синтеза углеводов, липидов. При гиповитаминозе наблюдается недостаток углеводов, липидов. Также развивается себорея – нарушения деятельности сальных желез.
Источники – мясо, молоко, печень, рыбий жир.
Витамин Аоению различают простые и сложные. ские реакции в организме. ств
Химическое название – ретинол, биологическое название — антиксерофтальмический
Роль витамина: — участвует в восприятии зрительных образов
— является антиоксидантом – защищает мембраны клеток от повреждений активными радикалами.
Образуется из предшественника β-каротина в печени.
При гиповитаминозе наблюдается куриная слепота, нарушается целостность мембран клеток.
Источники – морковь, перец, томаты, рыбий жир
Химическое название – эргокальцеферол, биологическое название – антирахитический. Образуется из холестерола при участии ультрафиолета.
Витамин Д участвует в процессах всасывания кальция в кишечнике и почках, что способствует его усвоению костями. При гиповитаминозе нарушается всасывание кальция в кишечнике, в результате наблюдается недостаток кальция и фосфора в организме, наблюдается ломкость костей, деформации скелета. У детей развивается рахит.
Химическое название – токоферол, биологическое название – антистерильный.
Участвует в процессах репродукции, является антиоксидантом.
При гиповитаминозе наблюдается бесплодие, невынашивание беременности, нарушение целостности мембран
Источники – растительные масла, подкожножировая клетчатка
Химическое название — менахинон, филлохинон, биологическое название – антигеморрагический
Является коферментом ферментов, которые участвуют в активации факторов свертывания крови. Поэтому при гиповитаминозе наблюдается снижение свертывания крови, частые кровотечения
Источники – растительная пища, микрофлора кишечника
Таким образом, поступление витаминов в организм зависит от состояния желудочно-кишечного тракта, т.е. причинами гиповитаминозов прежде всего являются заболевания пищеварительного тракта и нарушение деятельности микрофлоры кишечника.
Механизм действия ферментов
На первом этапе биохимической реакции происходит взаимодействие фермента с субстратом, образуется фермент-субстратный комплекс. На втором этапе происходит превращение субстрата при помощи активного центра фермента. На третьем этапе происходит отделение продуктов реакции.
Факторы, влияющие на активность ферментов
— ферменты проявляют наибольшую активность при температуре тела – 37 градусов; при снижении температуры активность фермента падает, но при нагревании препарата фермента до температуры тела его активность возобновляется. При температуре выше 40 градусов активность ферментов снижается из-за денатурации фермента, т.к. он является белком
— каждый фермент проявляет максимальную активность при определенной рН, например, фермент желудка пепсин активен при рН 1,5-2,0; ферменты тонкого кишечника работают при рН 7,5-8,0; фермент слюны амилаза требует рН 7,4
— при повышении количества фермента активность увеличивается
— при повышении количества субстрата активность фермента сначала увеличивается, затем не изменяется, т.к. весь фермент насыщен субстратом, и для того чтобы увеличить активность фермента нужно увеличить количество фермента.
Изоферменты – множественные формы фермента, которые катализируют одну и ту же реакцию, но различаются по физико-химическим свойствам: сродству к субстрату, подвижности при электрофорезе, регуляторным свойствам.
Например, фермент лактатдегидрогеназа (ЛДГ) – фермент с четвертичной структурой, содержит 2 типа субъединиц – М и Н. Молекула изоферментов ЛДГ образована 4 субъединицами. Поэтому ЛДГ имеет 5 изоферментов:
— ЛДГ2 состоит из НННМ – Н3М
— ЛДГ3 состоит из ННММ – Н2М2
— ЛДГ4 состоит из НМММ – НМ3
ЛДГ катализирует превращение пировиноградной кислоты в молочную кислоту (лактат).
При электрофорезе наибольшей подвижностью обладает изофермент ЛДГ1, наименьшей – ЛДГ5.
В скелетной мышце и миокарде преобладает активность ЛДГ1, а в печени – ЛДГ5. Это обстоятельство используют в клинической практике для диагностики заболеваний миокарда, скелетных мышц, печени. В норме активность изоферментов ЛДГ в сыворотке крови очень низкая. При повреждении соответствующих органов активность этих изоферментов возрастает в сыворотке крови. При увеличении активности ЛДГ1 в сыворотке крови подозревают поражение скелетных мышц или миокарда. Повышение активности ЛДГ5 в сыворотке крови может свидетельствовать о поражении печени.
Регуляция активности ферментов
Регуляция активности фермента осуществляется на уровне транскрипции и на уровне изменения активности синтезированного фермента.
Регуляция активности фермента на уровне транскрипции рассмотрена на примере лактозного оперона (в теме — Белки).
Регуляция активности синтезированного фермента происходит несколькими путями с участием гормонов.
А. Аллостерическая регуляция
В молекуле фермента различают аллостерический центр, который необходим для связывания различных веществ – активаторов и ингибиторов, которые регулируют активность фермента. Активаторы – вещества, ускоряющие активность ферментов. Например, ионы хлора увеличивают активность амилазы, соляная кислота активирует пепсин, желчь активирует липазу.
Ингибиторы – вещества, снижающие активность ферментов. Различают конкурентное и неконкурентное ингибирование. Конкурентный ингибитор имеет структурное сходство с субстратом, поэтому конкурентный ингибитор может взаимодействовать с активным центром фермента. При этом взаимодействие субстрата с активным центром фермента снижается и активность фермента падает. Неконкурентный ингибитор присоединяется к ферменту в аллостерическом центре, в результате меняется пространственная конфигурация активного центра фермента, и субстрат не может присоединяться к активному центру, поэтому активность фермента падает.
Активность фермента регулируется по принципу прямой положительной связи – присутствие субстрата активирует фермент. Отрицательная обратная связь – продукт реакции ингибирует ферменты, которые принимали участие в синтезе этого продукта на начальных стадиях.
Б. Ковалентная модификация
Этот путь регуляции активности ферментов заключается в следующем. В молекуле фермента присутствуют радикалы серина, тирозина, треонина. К спиртовым группам этих аминокислот присоединяется фосфат, источником которого служит АТФ. Присоединение фосфата к молекуле фермента называется фосфорилированием. Для этого процесса необходим фермент протенкиназа. При фосфорилировании фермент либо активируется, либо инактивируется.
Кроме того, может наблюдаться противоположная реакция – отщепление фосфата от молекулы фермента – дефосфорилирование. Для этого необходим фермент фосфопротеифосфатаза. При этом дефосфорилированный фермент может активироваться или инактивироваться.
Например, в синтезе гликогена участвует гликогенсинтетаза, а в распаде гликогена — гликогенфосфорилаза. Дефосфорилирование этих ферментов приводит к активации гликогенсинтетазы и ингибированию гликогенфосфорилазы, при этом преобладает синтез гликогена, а его распад замедляется. Фосфорилирование гликогенсинтетазы и гликогенфосфорилазы при водит к активации гликогенфосфорилазы и ингибированию гликогенсинтетазы, т.е. преобладает распад гликогена, а его синтез замедляется.
В. Регуляция активности фермента путем ассоциации-диссоциации субъединиц в олигомерном ферменте
Например, неактивная форма протеинкиназы представлена комплексом связанных субъединиц RRCC. При распаде этого комплекса на RR и С, С образуются активные формы фермента – С.
Применение ферментов в медицине
Энзимотерапия – применение ферментов в качестве лекарств. Например, при заболеваниях желудочно-кишечного тракта наблюдается ферментативная недостаточность желудка, поджелудочной железы. При этом нарушается переваривание белков, жиров, углеводов. Для улучшения процессов переваривания используются препараты, которые содержат ферменты, расщепляющие белки, жиры, углеводы в пищеварительном тракте. В хирургии для лечения гнойных ран используются протеолитические ферменты, которые расщепляют белки гнойного содержимого раны, поврежденных тканей, при этом рана лучше очищается от налета.
Высокая активность ферментов может приводить к развитию различных заболеваний. Поэтому в медицине применяются ингибиторы активности этих ферментов, что облегчает состояние больных.
В медицине ферменты стрептокиназа и урокиназа применяются для расщепления тромбов, в результате улучшается кровоток в поврежденных тканях.
Энзимодиагностика – определение активности органоспецифических ферментов в биологических жидкости и использование полученных результатов для диагностики заболеваний. В норме в крови активность ферментов низкая, т.к. ферменты преимущественно находятся в тканях органов – органоспецифичность. Если органы поражаются патологическим процессом, то ферменты из органов высвобождаются в кровь, и обнаруживается высокая активность ферментов в крови.
Ферменты, имеющие диагностическое значение
— аспартатаминотрансфераза – АСТ. Отмечена высокая активность АСТ в мышечной ткани, менее активен фермент в печени. Если в крови обнаруживается высокая активность АСТ, то можно предполагать поражение мышечной ткани или печени
— аланинаминотрансфераза – АЛТ. Отмечена высокая активность фермента в печени, менее активен фермент в мышечной ткани. При повышении активности АЛТ в крови можно предположить поражение печени или мышечной ткани.
— креатинфосфокиназа – КФК. Отмечена высокая активность КФК в мышечной ткани, мозге. При повышении активность КФК в крови можно предполагать поражение мышечной ткани, мозга
— лактатдегидрогеназа – ЛДГ. Отмечена высокая активность ЛДГ в мышечной ткани, печени. При повышении активность ЛДГ в крови модно предполагать поражение мышечной ткани или печени
— гаммаглутамилтранспептидаза. Отмечена высокая активность фермента в печени, почках. При повышении активность фермента в крови можно предполагать патологию печени, желчевыводящих ходов или почек
— щелочная фосфатаза. Отмечена высокая активность фермента в печени, костной ткани. При повышении активности щелочной фосфатазы в крови можно предполагать поражение печени и желчевыводящих ходов, костной ткани.
— панкреатическая амилаза. Отмечена высокая активность фермента в поджелудочной железе. При повышении активности амилазы в крови и моче можно предполагать патологию поджелудочной железы.
Описаны наследственные заболевания, которые связаны с дефектом или отсутствием каких-либо ферментов.
Ферменты используются в лабораторной практике для определения различных метаболитов в биологических жидкостях.
Дата добавления: 2014-01-07 ; Просмотров: 4303 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Ферменты – это биологические катализаторы. По химической природе ферменты являются белками.
Отличие ферментов от небиологических катализаторов (железо, платина и т.д.) заключается в следующем:
· скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами.
· ферменты обладают высокой специфичностью
· ферменты катализируют реакции в»мягких» условиях, т.е. при нормальном атмосферном давлении, физиологическом значении pH и температуре тела
· скорость ферментативного катализа может регулироваться
Вещество, которое превращаетсяпод действием фермента, называется «субстрат».
Структурно-функциональная организация ферментов
Так как по химической природе ферменты являются белками, то для них характерны все особенности структурной организации белков. Большинство ферментов имеют четвертичную структуру и являются сложными белками. Они состоят из белка – апофермента и кофактора. В роли кофакторов выступают ионы металлов или коферменты. Коферменты – это небольшие органические молекулы, которые принято разделять на 2 большие группы: витаминные и невитаминные. Исходными веществами для образования витаминных коферментов являются витамины. Поэтому недостаточное поступление их с пищей приводит к снижению синтеза этих коферментов и нарушению функционирования соответствующих ферментов. Невитаминные коферменты образуются в организме из промежуточных продуктов обмена веществ. Поэтому недостатка этих коферментов в физиологических условиях не бывает.
Классификация коферментов
I. Витаминные коферменты
1. Тиаминовые коферменты (производные витамина В1). ТМФ, ТДФ, ТТФ (тиаминмонофосфат, тиаминдифосфат и тиаминтрифосфат).
2. Флавиновые коферменты (производные витамина В2). ФМН (флавинмононуклетид), ФАД (флавинадениндинуклеотид)
3. Пантотеновые коферменты (производные витамина В3). КоА (кофермент А).
4. Никотинамидные коферменты (производные витамина В5) НАД (никотинамидадениндинуклеотид), НАДФ (никотинамидадениннуклеотидфосфат).
5. Пиридоксиновые коферменты (производные витамина В6). ПАЛФ (пиридоксальфосфат), ПАМФ (пиридоксаминфосфат).
6. Фолиевые коферменты (производные витамина В9). ТГФК (тетрагидрофолиевая кислота).
7. Биотиновые коферменты (производные витамина Н). Карбоксибиотин.
8. Кобамидные коферменты (производные витамина В12). Метилкобаламин, дезоксиаденозилкобаламин.
9. Липоевые коферменты (производные витамина N). Амид липоевой кислоты.
10. Хиноновые коферменты. Убихинон или кофермент Q.
11. Карнитиновые коферменты (производные витамина Вт). Карнитин.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Увлечёшься девушкой-вырастут хвосты, займёшься учебой-вырастут рога 9768 — 

195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник